题目内容
湿润的淀粉碘化钾试纸遇臭氧变蓝,化学方程式为:2KI+O3+H2O=2KOH+I2+O2下列叙述正确的是( )
| A、O3在反应中被还原为O2 |
| B、该反应的还原剂是H2O |
| C、1molO3在反应中得到2mol电子 |
| D、反应中氧化剂与还原剂的物质的量之比为2:1 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KI+O3+H2O=2KOH+I2+O2中,I元素的化合价升高,O元素的化合价降低,以此来解答.
解答:
解:A.O元素的化合价降低,则O3在反应中被还原生成KOH,故A错误;
B.I元素的化合价升高,则KI为还原剂,故B错误;
C.1molO3中,只有1molO得到电子,反应中得到1mol×[0-(-2)]=2mol电子,故C正确;
D.由反应可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选C.
B.I元素的化合价升高,则KI为还原剂,故B错误;
C.1molO3中,只有1molO得到电子,反应中得到1mol×[0-(-2)]=2mol电子,故C正确;
D.由反应可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2011年3月11日下午1点46分,日本发生了大海啸.为确保大灾之后无大疫,日本防疫部门使用了大量含氯类消毒剂,其中ClO2是杀菌效率高的杀毒剂,具有强氧化性.工业上制备ClO2化学反应的方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+2H2O,下列有关说法正确的是( )
| A、在反应中NaClO3是还原剂,Na2SO3是氧化剂 |
| B、有反应可得ClO2的氧化性大于NaClO3的氧化性 |
| C、该反应中,H2SO4中各元素的化合价没有发生变化 |
| D、1mol NaClO3参加反应,则有2mol电子转移 |
将一定量的MgCl2溶于90g水中,使每10个水分子中含有一个Cl-,则该MgCl2的物质的量是( )
| A、0.05mol |
| B、0.1mol |
| C、0.25mol |
| D、0.5mol |
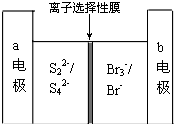 下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3
下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3| 放电 |
| 充电 |
Na2S4+3NaBr下述关于此电池说法正确的是( )
| A、充电的过程中当0.1mol Na+通过离子交换膜时,导线通过0.1mol电子 |
| B、电池放电时,负极反应为:3NaBr-2e═NaBr3+2Na |
| C、充电过程中,电极a与电源的正极相连 |
| D、放电过程中钠离子从右到左通过离子交换膜 |
硅被誉为无机非金属材料的主角.据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”“未来的石油”.下列有关说法正确的是( )
| A、地壳中硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 |
| B、硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 |
| C、常见的易溶硅酸盐是硅酸钠,硅酸钠是制备硅胶和木材防火剂的重要原料,实验室存放硅酸钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 |
| D、硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料 |
下列说法正确的是( )
A、室温下0.1 mol/L的NaHCO3溶液中,若pH>7,则c(CO
| ||
B、相同条件下,等物质的量浓度的NH4Cl和NH4HSO4溶液,前者溶液中NH
| ||
| C、在室温下,某溶液中由水电离出的c(H+)=10-3 mol/L,则此溶液可能是盐酸 | ||
| D、加水稀释稀醋酸溶液,溶液中所有离子浓度都会减小 |
下列离子方程式中正确的是( )
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ | ||
B、等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:
| ||
| C、向稀硫酸中加入铜粉:Cu+2H+=Cu2++H2↑ | ||
| D、向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
 可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: