题目内容
11.有关碱金属元素,下列说法正确的是( )| A. | 单质沸点随原子序数的递增而升高 | |
| B. | 周期表第一列是第ⅠA 族元素,又称碱金属元素 | |
| C. | 金属锂常用于制造锂电池,这跟它还原性强、密度小有关 | |
| D. | 金属锂在空气中燃烧,产物是 Li2O2 |
分析 A.碱金属沸点,金属键依次减弱,金属键越强,熔点越高;
B.周期表第一列中含氢元素;
C.锂还原性强,锂是自然界密度最小的金属元素;
D.锂性质较活泼,金属锂在空气中燃烧时,生成Li2O.
解答 解:A.碱金属,从上到下电子层增多,半径依次增大,金属键依次减弱,熔点沸点依次降低,故A错误;
B.周期表第一列中含氢元素,是除氢外的其他金属为碱金属,故B错误;
C.锂电池的负极失电子,发生氧化反应,而金属锂有强还原性,易失电子,质量小常用于制造锂电池,故C正确;
D.锂在空气中燃烧不能生成过氧化锂,故D错误;
故选C.
点评 本题考查碱金属性质,为高频考点,明确同一主族元素原子结构、性质及其关系即可解答,注意碱金属族元素中只有Li在空气中燃烧生成一种化合物,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.铝广泛应用于电气工业、飞机制造等行业,铝在空气中能稳定存在的原因是( )
| A. | 化学性质稳定 | B. | 还原性很强 | ||
| C. | 不与O3反应 | D. | 易与O2形成致密的氧化膜 |
2.下列说法正确的是( )
| A. | 氯气、液氯和氯水是同一种物质 | |
| B. | Na2O、Na2O2组成元素相同,与CO2都能发生氧化还原反应 | |
| C. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
19.下列关于有机物的说法正确的是( )
| A. | C4H8Cl2有9种同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | 乙醇、乙酸均能与NaOH 溶液反应 |
6.如图所示可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法正确的是( )


| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 反应产生的热效应Q=E1-E2 | |
| C. | a与b相比,反应的平衡常数一定不同 | |
| D. | a与b相比,a的反应速率更快 |
16.根据所学知识,判断下列叙述中正确的是( )
| A. | 足量稀硫酸与少量锌反应,滴加少量 CuSO4 溶液,加快了反应速率,不影响 H2总量 | |
| B. | 足量的锌和少量稀硫酸反应,加入醋酸钠溶液降低反应速率,减少了生成的 H2总量 | |
| C. | 2-甲基丙烷光照下与氯气反应,得到 3 种一氯代物 | |
| D. | 仅用水就能鉴别酒精和己烷 |
3.下列化学用语表达不正确的是( )
①丙烷的分子式为:CH3CH2CH3
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3?二甲基戊烷
④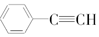 与C8H6互为同分异构体.
与C8H6互为同分异构体.
①丙烷的分子式为:CH3CH2CH3
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3?二甲基戊烷
④
 与C8H6互为同分异构体.
与C8H6互为同分异构体.| A. | ①③ | B. | ①②④ | C. | ③④ | D. | ②③ |
20.下列关于硅的化合物叙述正确的是( )
| A. | 二氧化硅晶体是由SiO2分子构成的,它的熔点低、硬度大 | |
| B. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| C. | 将硫酸和碳酸钠反应产生的气体通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2既能与NaOH溶液反应又能与氢氟酸反应,所以SiO2是两性氧化物 |