题目内容
16.根据所学知识,判断下列叙述中正确的是( )| A. | 足量稀硫酸与少量锌反应,滴加少量 CuSO4 溶液,加快了反应速率,不影响 H2总量 | |
| B. | 足量的锌和少量稀硫酸反应,加入醋酸钠溶液降低反应速率,减少了生成的 H2总量 | |
| C. | 2-甲基丙烷光照下与氯气反应,得到 3 种一氯代物 | |
| D. | 仅用水就能鉴别酒精和己烷 |
分析 A.Zn置换出Cu,加快反应速率,但生成氢气减少;
B.Zn足量,酸中氢离子不变;
C.2-甲基丙烷含2种H;
D.酒精与水互溶,己烷和水分层.
解答 解:A.滴加少量 CuSO4 溶液,Zn置换出Cu,加快反应速率,但生成氢气减少,故A错误;
B.Zn足量,酸中氢离子不变,则加入醋酸钠溶液降低反应速率,生成的 H2总量不变,故B错误;
C.2-甲基丙烷含2种H,光照下与氯气反应,得到2种一氯代物,故C错误;
D.酒精与水互溶,己烷和水分层,则用水就能鉴别酒精和己烷,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握反应速率的影响因素、有机物的结构、物质的鉴别为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
6.将下列气体通入酸性高锰酸钾溶液,能使酸性高锰酸钾溶液褪色的是( )
| A. | CH1 | B. | CO2 | C. | SO2 | D. | H2 |
7.草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解.常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5.回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为B-E-D(填字母序号).
(2)相同温度条件下,分别用3支试管按下列要求完成实验:
写出试管B的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?能(选填“能”或“不能”);简述你的理由:实验中KMnO4的浓度cB>cA,且其反应速率νB>νA.
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有AC(填序号).
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH>7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH<a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL.
①所用指示剂为酚酞;滴定终点时的现象为锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化;
②H2C2O4溶液物质的量浓度为0.05000mol/L;
③下列操作会引起测定结果偏高的是AD(填序号).
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数.
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为B-E-D(填字母序号).

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
| 试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有AC(填序号).
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH>7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH<a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL.
①所用指示剂为酚酞;滴定终点时的现象为锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化;
②H2C2O4溶液物质的量浓度为0.05000mol/L;
③下列操作会引起测定结果偏高的是AD(填序号).
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数.
4.下列说法中正确的是( )
| A. | 丙烯所有原子均在同一平面上 | |
| B. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应 | |
| D. | 分子式为C8H10的某芳香烃的一氯代物可能只有一种 |
11.有关碱金属元素,下列说法正确的是( )
| A. | 单质沸点随原子序数的递增而升高 | |
| B. | 周期表第一列是第ⅠA 族元素,又称碱金属元素 | |
| C. | 金属锂常用于制造锂电池,这跟它还原性强、密度小有关 | |
| D. | 金属锂在空气中燃烧,产物是 Li2O2 |
1.下列物质的化学用语表达正确的是( )
| A. | 甲烷的球棍模型: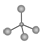 | B. | 羟基的电子式: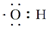 | ||
| C. | 乙醛的结构式:CH3CHO | D. | (CH3)3COH的名称:2,2二甲基乙醇 |
8.下列有关卤代烃说法正确的是( )
| A. | 检验溴乙烷中是否有溴元素,方法是先加入NaOH溶液共热,冷却后用过量稀硝酸中和过量碱,再加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| B. | 卤代烃水解后的有机产物一定为醇 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
5.某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A. |  图中:如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气 | |
| C. |  图中:生成蓝色的烟 | |
| D. |  图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
16.下列解释事实的方程式不正确的是( )
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑十+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S↓+2I- |