题目内容
10. A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.①B中Sn极的电极反应式为2H++2e-=H2↑,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)增大.
②A中总反应离子方程式为Fe+2H+=Fe2++H2↑.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C.
分析 ①根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
②铁的化学性质,能与酸反应;电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答 解:①铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
②铁与硫酸反应的离子方程式为:Fe+2H+=Fe2++H2↑,A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,故答案为:Fe+2H+=Fe2++H2↑;B>A>C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
20.下列微粒中,同时具有离子键、共价键和配位键的是( )
| A. | NaOH | B. | H3O+ | C. | MgCl2 | D. | NH4Cl |
1.下列说法正确的是( )
| A. | 二氧化硫能使品红溶液褪色是因为SO2具有氧化性 | |
| B. | 新制氯水的氧化性强于久置氯水 | |
| C. | 检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 | |
| D. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
18.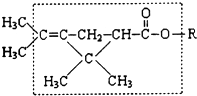 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
5.在恒温、恒容的密闭容器中进行反应2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.若H2O2溶液的浓度由2.0mol•L-1降到1.0mol•L-1需10s,那么H2O2浓度由1.0mol•L-1降到0.5mol•L-1所需的反应时间为( )
| A. | 5 s | B. | 大于5 s | C. | 小于5 s | D. | 无法判断 |
2.含有离子键的物质是( )
| A. | Cl2 | B. | O3 | C. | NH3 | D. | KOH |
19.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随着加入的NaOH溶液体积变化如图所示,下列说法正确的是
 ( )
( )
 ( )
( )| A. | 原溶液中可能含有Na+、CO32- | |
| B. | 原溶液中一定含有H+、NH4+、Al3+、Mg2+、Fe3+、SO42- | |
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为2:1 | |
| D. | CD段溶液中含有的溶质只有Na2SO4、NaAlO2 |
20.下列说法中正确的是( )
| A. | 同周期元素的电子层数都相同 | |
| B. | 同族元素的最外层电子数一定相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |