题目内容
1.某同学的实验报告中有如下数据,其中数据合理的是( )| A. | 用托盘天平称取3.25g NaCl | |
| B. | 用酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用量筒量取10.51 mL盐酸 | |
| D. | 用容量瓶配制216mL 0.1mol/L NaOH溶液 |
分析 A.托盘天平只能精确到0.1;
B.滴定管精确到0.01;
C.从量筒的精确度考虑,量筒只能精确到0.1;
D.容量瓶只能用来配制固定容积的溶液.
解答 解:A.托盘天平只能精确到0.1,用托盘天平无法称取3.25gNaCl,故A错误;
B.滴定管精确到0.01,高锰酸钾具有氧化性,腐蚀橡皮管,应用酸式滴定管,故B正确;
C.量筒只能精确到0.1,不能量取10.51mL盐酸,故C错误;
D.容量瓶只能用来配制固定容积的溶液,没有216mL的容量瓶,故D错误.
故选B.
点评 本题考查常用计量仪器的精确度问题,题目难度不大,本题易错点为D项,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
11.光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光导纤维是由下列哪种物质经特殊工艺制成的( )
| A. | SiC | B. | SiO2 | C. | Si | D. | Si3N4 |
12.下列说法不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | B. | Na2CO3比NaHCO3稳定 | ||
| C. | Na2CO3和NaHCO3都能与盐酸反应 | D. | Na2CO3俗名:小苏打 |
9.在Na+的物质的量浓度为0.5mol•L-1的某澄清溶液中,还可能含有如下离子:K+、Mg2+、Ba2+、NO3-、CO32-、SO42-.取100mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
下列说法正确的是( )
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
下列说法正确的是( )
| A. | 一定不存在的离子是Mg2+、Ba2+,不能确定是否含有K+、NO3- | |
| B. | 一定存在的离子是CO32-、SO42-,CO32-的物质的量浓度为0.25mol•L-1,SO42-的物质的量浓度为0.1mol•L-1 | |
| C. | 一定存在的离子是CO32-、SO42-、K+,其中K+浓度≥0.2mol•L-1 | |
| D. | 一定存在的离子是CO32-、SO42-、K+,其中K+浓度为0.2mol•L-1 |
16.在某酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Fe3+、Mg2+、SO42-、NO3- | D. | Cu2+、K+、NO3-、I- |
6.现在甲基、羟基、羧基、苯基四种原子团,两两组合形成化合物,其水溶液呈酸性的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- | |
| B. | 加入AgNO3溶液生成白色沉淀,则原溶液中一定含有Cl- | |
| C. | 加入KSCN溶液时,溶液不变红色,再滴入氯水溶液变为红色,则原溶液中一定含有Fe2+ | |
| D. | 加入盐酸,生成的气体能使成清石灰水变浑浊,则原溶液中一定含有CO32- |
11.下列各项中,括号里的物质是除杂质所选用的药品,其中错误的是( )
| A. | CO中混有CO2(NaOH溶液) | B. | H2中混有HCl(NaOH溶液) | ||
| C. | NO中混有NO2(水) | D. | CO2中混有HCl(饱和Na2CO3溶液) |
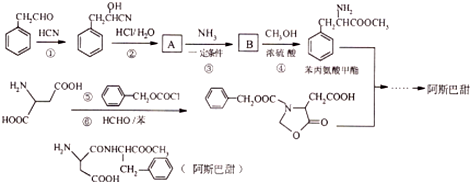
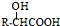 $→_{一定条件}^{NH_{3}}$
$→_{一定条件}^{NH_{3}}$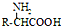
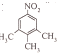 、
、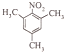 ;
;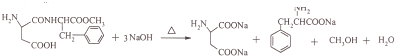 ;
; 的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH:
的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH: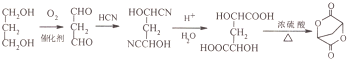 .
.