题目内容
计算题
将xmL NO和NO2的混合气体通入水吸收后,得到amL无色气体A,将此无色气体A与等体积的O2混合,再通入水充分吸收后,收集到5mL无色气体B.
(1)请判断无色气体A、B是什么?(2)A气体的体积是多少?(3)x的取值范围是什么?
将xmL NO和NO2的混合气体通入水吸收后,得到amL无色气体A,将此无色气体A与等体积的O2混合,再通入水充分吸收后,收集到5mL无色气体B.
(1)请判断无色气体A、B是什么?(2)A气体的体积是多少?(3)x的取值范围是什么?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据反应3NO2+H2O=2HNO3+NO,得出无色气体A为NO,再根据4NO+3O2+2H2O=4HNO3,得到无色气体B是氧气;
(2)根据过量的氧气为5mL,根据开始反应时NO与O2的体积相等,利用反应4NO+3O2+2H2O=4HNO3求出NO的体积;
(3)利用极限法求出V的范围,只有NO时x的值最小,只有NO2时x的值最大.
(2)根据过量的氧气为5mL,根据开始反应时NO与O2的体积相等,利用反应4NO+3O2+2H2O=4HNO3求出NO的体积;
(3)利用极限法求出V的范围,只有NO时x的值最小,只有NO2时x的值最大.
解答:
解:(1)因NO不与水反应,NO2能与水反应:3NO2+H2O=2HNO3+NO,所以无色气体A为NO,无色气体A与等体积的O2混合通过水后发生反应:4NO+3O2+2H2O=4HNO3,氧气过量,则无色气体B为氧气,
答:无色气体A为NO、B为O2;
(2)设NO与O2的体积都是VmL,由于过量的氧气为5mL,则:
4NO+3O2+2H2O=4HNO3,
VmL
VmL
故VmL-
VmL=5mL,解得V=20,
答:无色气体NO的体积为20mL;
(3)若x mL气体全部NO,x的值最小,则x=20,
若x mL气体全部NO2,x的值最大,根据反应3NO2+2H2O=2HNO3+NO,可知x=60,
所以混合气体的体积:20<x<60,
答:x的取值范围是20<x<60.
答:无色气体A为NO、B为O2;
(2)设NO与O2的体积都是VmL,由于过量的氧气为5mL,则:
4NO+3O2+2H2O=4HNO3,
VmL
| 3 |
| 4 |
故VmL-
| 3 |
| 4 |
答:无色气体NO的体积为20mL;
(3)若x mL气体全部NO,x的值最小,则x=20,
若x mL气体全部NO2,x的值最大,根据反应3NO2+2H2O=2HNO3+NO,可知x=60,
所以混合气体的体积:20<x<60,
答:x的取值范围是20<x<60.
点评:本题主要考查了混合物有关计算,明确发生的反应是解题关键,(3)中注意利用极限法进行解答.

练习册系列答案
相关题目
在Na原子和Na+离子这两种粒子中,相等的是( )
| A、质子数 | B、核外电子层数 |
| C、电子数 | D、最外层电子数 |
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.下列说法正确的是( )
| A、五种元素中原子半径最大的是E,最小的是A |
| B、A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物 |
| C、E最高价氧化物对应水化物化学式为H2EO4 |
| D、C的单质在空气中燃烧产物的化学式为C2O |
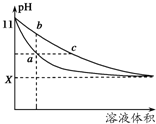 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A、a点导电能力比b点强 |
| B、对于b、c两点,Kb>Kc |
| C、与盐酸完全反应时,消耗盐酸体积Va>Vc |
| D、X的值接近7,但大于7 |



 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为