题目内容
 已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:(1)写出C和I的化学式:
(2)写出反应①的化学方程式:
(3)写出反应①在工业上的一种用途
考点:无机物的推断
专题:推断题
分析:A是地壳中含量最高的金属元素,则A为Al,G为紫红色金属,则G为Cu,B是一种红棕色金属氧化物,为Fe2O3,反应①为铝热反应,可知单质金属C为Fe,D为Al2O3,反应②在工业上可用于制作印刷电路板,应是氯化铁与Cu的反应,而C与F反应生成G,可推知F为Cl2、H为FeCl3,结合转化关系可知G为FeCl2,K为CuCl2,E为HCl,H与I反应呈血红色,则I为KSCN.
解答:
解:A是地壳中含量最高的金属元素,则A为Al,G为紫红色金属,则G为Cu,B是一种红棕色金属氧化物,为Fe2O3,反应①为铝热反应,可知单质金属C为Fe,D为Al2O3,反应②在工业上可用于制作印刷电路板,应是氯化铁与Cu的反应,而C与F反应生成G,可推知F为Cl2、H为FeCl3,结合转化关系可知G为FeCl2,K为CuCl2,E为HCl,H与I反应呈血红色,则I为KSCN,
(1)由上述分析可知,C为Fe,I为KSCN,故答案为:Fe;KSCN;
(2)反应①的化学方程式为:2Al+Fe2O3
Al2O3+2Fe,
反应②的离子方程式为:2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Al+Fe2O3
Al2O3+2Fe;2Fe3++Cu=Cu2++2Fe2+;
(1)反应①是Al与氧化铁反应生成Fe与氧化铝,是铝热反应,可以用于焊接铁轨等,
故答案为:焊接铁轨.
(1)由上述分析可知,C为Fe,I为KSCN,故答案为:Fe;KSCN;
(2)反应①的化学方程式为:2Al+Fe2O3
| ||
反应②的离子方程式为:2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Al+Fe2O3
| ||
(1)反应①是Al与氧化铁反应生成Fe与氧化铝,是铝热反应,可以用于焊接铁轨等,
故答案为:焊接铁轨.
点评:本题考查无机物推断,物质颜色及特殊的反应现象、用途是推断的关键,注意识记中学常见的工业原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温常压下,把二氧化碳和一氧化氮的混合气体V mL缓缓通过足量的过氧化钠固体,气体体积缩小到
mL,则二氧化碳和一氧化氮的体积比不可能是( )
| v |
| 2 |
| A、2:1 | B、3:2 |
| C、3:4 | D、5:4 |
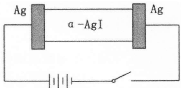 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |



 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:

 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为