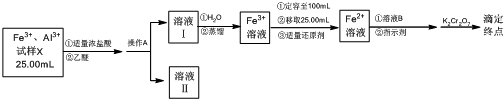
题目内容
10.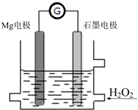 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 石墨电极是该电池的正极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| D. | 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极 |
分析 该装置中Mg易失电子作负极,电极反应式为Mg-2e-=Mg2+,石墨电极是该电池的正极,H2O2具有氧化性,应在原电池的正极被还原,电极反应式为H2O2+2H++2e-═2H2O,据此分析解答.
解答 解:A.Mg易失电子发生氧化反应而作负极,石墨电极是该电池的正极,故A正确;
B.H2O2在石墨电极上得电子发生还原反应,故B正确;
C.Mg易失电子发生氧化反应而作负极,电极反应为:Mg-2e-=Mg2+,故C正确;
D.电池工作时,电子从负极Mg电极经导线流向石墨电极,但是电子不会经过电解质溶液,故D错误;
故选D.
点评 本题考查了原电池原理,由Mg、双氧水的性质确定正负极,会正确书写电极反应式,知道离子移动方向,题目难度不大.

练习册系列答案
相关题目
4.下列分子中的14个碳原子一定会处于同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
1.已知反应CO(g)+Cl2(g)?COCl2(g)在某温度恒容条件下进行,反应开始时c(CO)=0.0350mol•L-1,c(Cl2)=0.0270mol•L-1,c(COCl2)=0.011 mol•L-1,达到平衡时,C(COCl2)=0.032mol•L-1.该条件下氯气的转化率是( )
| A. | 60% | B. | 77.8% | C. | 48.0% | D. | 34.4% |
18.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaCl | B. | NH4Cl | C. | Na2CO3 | D. | NaOH |
5.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 正、逆反应速率都为零 |
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |