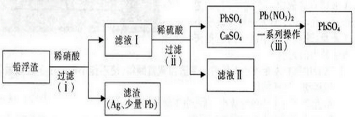
题目内容
5.下列说法正确的是( )| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 将海水蒸干可以直接获得食用盐 |
分析 A.不活泼金属在自然界中能够以游离态存在;
B.金属镁的沸点高于金属钾的沸点;
C.根据能量转化的方式分析;
D.海水中除了含有氯化钠外还含有其他盐.
解答 解:A.不活泼金属在自然界中能够以游离态存在,如金等,故A错误;
B.工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼是利用高沸点制备低沸点原理,故B正确;
C.因朝汐发电是朝汐能转化为电能,故B错误;
D.海水中除了含有氯化钠外还含有其他盐,将海水蒸干得到的盐不能食用,故D错误;
故选:B.
点评 本题为综合题,涉及金属的冶炼、金属在自然界中存在形态、能量转化等,题目难度不大.

练习册系列答案
相关题目
15.随着资源的开发和现代化工业的发展,你认为减少酸雨以保护环境可采取的措施是( )
①尽量少用煤作燃料 ②把工厂的烟囱加高 ③将燃料脱硫后才燃烧 ④开发新的清洁能源 ⑤植树造林 ⑥在已酸化的土壤中加石灰.
①尽量少用煤作燃料 ②把工厂的烟囱加高 ③将燃料脱硫后才燃烧 ④开发新的清洁能源 ⑤植树造林 ⑥在已酸化的土壤中加石灰.
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ①③④ | D. | ①③④⑤ |
16.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
20.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U 形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列( )物质后,发生如图所示变化.
①NH4NO3晶体; ②浓H2SO4; ③NaOH粉末;
④NaCl晶体 ⑤Na2O2固体; ⑥生石灰.
①NH4NO3晶体; ②浓H2SO4; ③NaOH粉末;
④NaCl晶体 ⑤Na2O2固体; ⑥生石灰.

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
10.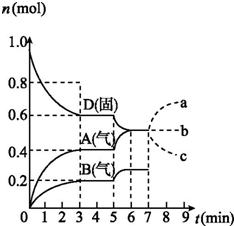 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,B物质的平均反应速率为0.033 3 mol/(L•min) | |
| B. | 根据右图该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 若在第5 min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7 分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
17.相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 | |
| B. | 平衡时,两个容器中NH3 的体积分数均为1/8 | |
| C. | 容器②中达平衡时放出的热量Q=4.63 kJ | |
| D. | 若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ |
14.下列分子中含有两个π键的是( )
| A. | O2 | B. | N2 | C. | H2O | D. | NH3 |
11.下列电离或水解方程式书写不正确的是( )
| A. | 碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3- HCO3-?H++CO32- | |
| B. | 偏铝酸钠的水解方程式为:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑ | |
| D. | 醋酸铵的水解方程式为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O |