题目内容
7.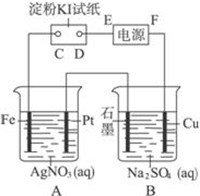 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
分析 A装置中收集到的是O2,B装置中收集到的是H2,两者的体积比为1:2,设O2的物质的量为x,根据转移电子守恒进行解答.
解答 解:A装置中收集到的是O2,B装置中收集到的是H2,两者的体积比为1:2,设O2的物质的量为x,则有3x=1.68 L÷22.4 L•mol-1=7.5×10-2 mol,x=2.5×10-2 mol,A中消耗n(OH-)=4×2.5×10-2=0.1 mol,余n(H+)=0.1 mol,c(H+)=0.1 mol÷1 L=0.1 mol•L-1,pH=1.
故答案为:pH=1.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确利用方程式计算pH.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列化学用语书写正确的是( )
| A. | NH4Cl的电子式: | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
18.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯 | |
| B. | 乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯 | |
| C. | 溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
15.用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
2.在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g),某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
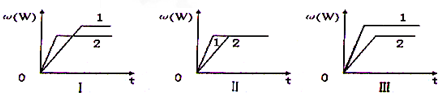
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析正确的是( )

其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析正确的是( )
| A. | 图I可能是不同压强对反应的影响,且p2>p1,a+b>n | |
| B. | 图I可能是不同温度对反应的影响,且T2>T1,△H>0 | |
| C. | 图II可能是不同压强对反应的影响,且p1>p2,n=a+b | |
| D. | 图Ⅲ可能是不同温度对反应影响,且T1>T2,△H<0 |
12.微量元素硒(Se)对人体有保健作用,含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 最高价氧化物的水化物显酸性 | B. | 非金属性比溴强 | ||
| C. | 原子序数为24 | D. | 氢化物比H2S稳定 |
19.某可逆反应当正反应速率增大时,下列说法正确的是( )
| A. | 逆反应速率一定增大 | B. | 该反应的条件一定发生变化 | ||
| C. | 反应物的转化率一定增大 | D. | 平衡一定向正反应方向进行 |
