题目内容
11.下列叙述正确的是( )| A. | 标准状况下1mol的水所占的体积约为22.4L | |
| B. | 标准状况下2g H2所占的体积约为22.4L | |
| C. | 常温常压下1mol的水所占的体积约为22.4L | |
| D. | 常温常压下2g H2所占的体积约为22.4L |
分析 A.标况下水不是气体;
B.根据n=$\frac{m}{M}$计算氢气物质的量,标况下气体摩尔体积约是22.4L/mol;
C.常温常压下水不是气体;
D.常温常压下气体摩尔体积不是22.4L/mol,而是大于22.4L/mol.
解答 解:A.标况下水不是气体,不能利用气体摩尔体积计算其体积,1mol的水所占的体积远远小于22.4L,故A错误;
B.2g H2所物质的量为$\frac{2g}{2g/mol}$=1mol,标况下气体摩尔体积约是22.4L/mol,氢气占有的条件约是22.4L,故B正确;
C.常温常压下水不是气体,不能利用气体摩尔体积计算其体积,故C错误;
D.常温常压下气体摩尔体积不是22.4L/mol,而是大于22.4L/mol,常温常压下2g H2所占的体积大于22.4L,故D错误.
故选:B.
点评 本题考查气体摩尔体积与物质的量计算,注意气体摩尔体积的使用条件与对象,根据PV=nRT理解温度、压强对气体摩尔体积的影响.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
1.下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
2.在消毒剂家族中,臭氧和过氧乙酸的贡献并驾齐驱.O3可以看成是一个O2分子携带一个O原子,利用其自身的强氧化性杀灭病菌,反应后放出无污染的O2.下列关于O3说法中正确的是( )
| A. | O3与O2互为同分异构体 | B. | O3与O2互为同素异形体 | ||
| C. | 使用时浓度大小对人体无害 | D. | O3遇氟氯烷烃不会分解 |
19.常温下用0.1000mol•L-1Na0H溶液滴定20.00mol某未知浓度的醋酸溶液,滴定曲线如图.
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )
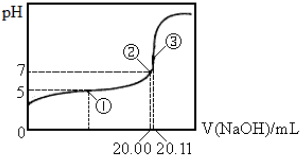
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )

| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
6.下列关于有机物的说法中,正确的是( )
| A. | 乙醇可以氧化为乙醛或乙酸,三者都能发生酯化反应 | |
| B. | 苯酚钠溶液中通入CO2生成苯酚,表明苯酚的酸性比碳酸的强 | |
| C. | 乙酸乙酯在酸性或碱性条件下都能发生水解反应 | |
| D. | 可用FeCl3溶液来区分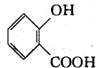 和 和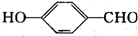 |
3.下列几种物质中,属于有机物的是( )
| A. | H2O | B. | Cl2 | C. | 香醋 | D. | CO2 |
20.复分解反应中有一规律:强酸与弱酸盐反应可以生成弱酸(如2HCl+CaCO3=CaCl2+H2O+CO2↑);在常温下,测得下列酸溶液(浓度均为a%)酸性强弱顺序:H2SO4>HCl>H2S>H2CO3>HClO;下列反应均能发生,其中不符合该规律的是( )
| A. | H2SO4+2NaHCO3═2NaCl+2H2O+2CO2↑ | B. | 2HCl+BaS═BaCl2+H2S↑ | ||
| C. | CO2+H2O+Ca(ClO)2═CaCO3↓+2HClO | D. | H2S+CuSO4═CuS↓+H2SO4 |