题目内容
 F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑
下列推测正确的是
A、XeF2分子中各原子均达到八电子结构
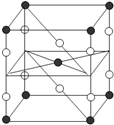
B、某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6
C、XeF4按已知方式水解,每生成4molXe,转移16mol电子
D、XeF2加入水中,在水分子作用下将重新生成Xe和F2
C
解析:
本题综合考查分子结构、晶体结构、氧化还原反应及氟气的性质,属较难题。Xe原子本身就是8电子结构,再与F原子结合,肯定就不再是了,所以A错;晶胞中Xe原子个数为:8×1/8+1=2,F原子个数为:8×1/4+2=4,故原子个数比Xe:F=1:2,其化学式为XeF2,B错;由题中化学方程式可知,生成3molO2失12mol电子,生成2molXeO3失4mol电子,生成4molXe得16mol电子,所以转移电子总数为12mol,故C正确;F2与水会剧烈反应,所以在溶液中不可能生成F2,D也错。易错警示:晶胞结构中质点的占有率通常采用“均摊法”,不少同学掌握不好而在此出错。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )| A、XeF2分子中各原子均达到八电子结构 | B、某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6 | C、XeF4按已知方式水解,每生成4molXe,转移16mol电子 | D、XeF2加入水中,在水分子作用下将重新生成Xe和F2 |