题目内容
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。
下列判断中正确的是
A.F一般无正价,但在HFO中的F价态为+1
B.XeF2分子中各原子均达到8电子结构
C.XeF4按已知方式水解,反应中氧化剂为XeF4、还原剂为H2O
D.XeF4按已知方式水解,每生成4molXe,转移16mol电子
【答案】
D
【解析】略

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
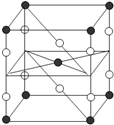 F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )
F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )| A、XeF2分子中各原子均达到八电子结构 | B、某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6 | C、XeF4按已知方式水解,每生成4molXe,转移16mol电子 | D、XeF2加入水中,在水分子作用下将重新生成Xe和F2 |