题目内容
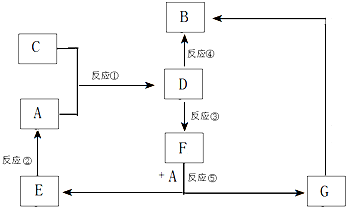 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能将某种能使品红褪色的酸性氧化物氧化为F,且F是一种强酸.
请回答下列问题:
(1)如图反应③④⑤中属于置换反应的是
(2)写出物质D和G的化学式:D
(3)G生成B有多种途径.若在G的溶液中加入Na2O2,且二者的物质的量之比为2:1,能使G转化为B,写出该反应的离子方程式:
(4)请写出实验室制气体C的化学方程式
对气体C进行如下实验.已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个.请按照要求填空:
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
考点:无机物的推断
专题:推断题
分析:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能将某种能使品红褪色的酸性氧化物氧化为F,且F是一种强酸.
E为密度最小的气体是H2;G为浅绿色溶液说明含有Fe2+;D为黄色溶液,说明含有Fe3+,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以D为FeCl3;A是金属,A和C反应生成氯化铁,所以A是Fe,C是Cl2;氯化铁能转化为红褐色固体B,所以B是Fe(OH)3;F和铁反应生成氢气和亚铁盐,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁,然后结合元素化合物性质及化学用语来解答.
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能将某种能使品红褪色的酸性氧化物氧化为F,且F是一种强酸.
E为密度最小的气体是H2;G为浅绿色溶液说明含有Fe2+;D为黄色溶液,说明含有Fe3+,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以D为FeCl3;A是金属,A和C反应生成氯化铁,所以A是Fe,C是Cl2;氯化铁能转化为红褐色固体B,所以B是Fe(OH)3;F和铁反应生成氢气和亚铁盐,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁,然后结合元素化合物性质及化学用语来解答.
解答:
解:E为密度最小的气体是H2;G为浅绿色溶液说明含有Fe2+;D为黄色溶液,说明含有Fe3+,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以D为FeCl3;A是金属,A和C反应生成氯化铁,所以A是Fe,C是Cl2;氯化铁能转化为红褐色固体B,所以B是Fe(OH)3;F和铁反应生成氢气和亚铁盐,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁;
(1)一种单质和一种化合物反应生成另外的单质和化合物的化学反应是置换反应,反应③中是氯化铁和二氧化硫反应生成硫酸,不属于置换反应,⑤中硫酸和铁反应生成硫酸亚铁和氢气属于置换反应,故答案为:⑤;
(2)铁盐有氧化性,二氧化硫有还原性,所以铁离子和二氧化硫发生氧化还原反应生成亚铁离子和硫酸,反应离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,A为Fe和硫酸反应生成G为硫酸亚铁,E为H2,所以D为FeCl3,G为FeSO4 ;
(3)G生成B有多种途径.若在G的溶液中加入Na2O2,且二者的物质的量之比为2:1,能使G转化为B,硫酸亚铁有还原性,过氧化钠有强氧化性,二者能发生氧化还原反应生成氢氧化铁和氧气,反应离子方程式为6Fe2++3Na2O2+6H2O═4Fe(OH)3+6Na++2Fe3+;
故答案为:6Fe2++3Na2O2+6H2O═4Fe(OH)3+6Na++2Fe3+;
(3)实验室用二氧化锰和浓盐酸在加热条件下制取氯气,反应方程式为:MnO2+4HCl(浓)
nCl2+Cl2↑+2H2O;
氯气有强氧化性,碘离子有还原性,所以二者能发生氧化还原反应生成碘单质,淀粉溶液遇碘变蓝色,所以看到的现象是溶液变蓝色,反应离子方程式为:Cl2+2I-=I2+2Cl-;继续通入氯气,氯气能氧化碘单质生成碘酸,导致溶液褪色,所以看到的现象是溶液褪色,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(1)一种单质和一种化合物反应生成另外的单质和化合物的化学反应是置换反应,反应③中是氯化铁和二氧化硫反应生成硫酸,不属于置换反应,⑤中硫酸和铁反应生成硫酸亚铁和氢气属于置换反应,故答案为:⑤;
(2)铁盐有氧化性,二氧化硫有还原性,所以铁离子和二氧化硫发生氧化还原反应生成亚铁离子和硫酸,反应离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,A为Fe和硫酸反应生成G为硫酸亚铁,E为H2,所以D为FeCl3,G为FeSO4 ;
(3)G生成B有多种途径.若在G的溶液中加入Na2O2,且二者的物质的量之比为2:1,能使G转化为B,硫酸亚铁有还原性,过氧化钠有强氧化性,二者能发生氧化还原反应生成氢氧化铁和氧气,反应离子方程式为6Fe2++3Na2O2+6H2O═4Fe(OH)3+6Na++2Fe3+;
故答案为:6Fe2++3Na2O2+6H2O═4Fe(OH)3+6Na++2Fe3+;
(3)实验室用二氧化锰和浓盐酸在加热条件下制取氯气,反应方程式为:MnO2+4HCl(浓)
| ||
氯气有强氧化性,碘离子有还原性,所以二者能发生氧化还原反应生成碘单质,淀粉溶液遇碘变蓝色,所以看到的现象是溶液变蓝色,反应离子方程式为:Cl2+2I-=I2+2Cl-;继续通入氯气,氯气能氧化碘单质生成碘酸,导致溶液褪色,所以看到的现象是溶液褪色,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:MnO2+4HCl(浓)
| ||
| 实验步骤 | 实验现象 | 用化学用语解释 |
蓝 色 | Cl2+2I-═2Cl-+I2 | |
| 5Cl2+I2+6H2O═2HIO3+10HCl |
点评:本题考查无机物的推断,为高频考点,综合考查了元素化合物的性质,把握以“D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀”为题眼来正确推断物质是解本题的关键,注意铁离子能把二氧化硫氧化呈硫酸不是三氧化硫,题目难度中等.

练习册系列答案
相关题目
对于固定体积的密闭容器中进行的气体反应可以说明A(g)+B(g)?C(g)+D(g)在恒温下已达到平衡的是( )
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
欲使CuSO4?5H2O、NH4Cl和SiO2的混合物分离开来,其必要的实验操作为( )
| A、加热 溶解 过滤 结晶 |
| B、溶解 过滤 蒸发 结晶 |
| C、加热 溶解 蒸发 过滤 |
| D、溶解 过滤 蒸馏 蒸发 |
下列各项比较中不正确的是( )
| A、电负性:F>O>N |
| B、第一电离能:Mg>Al>Na |
| C、结合质子能力:OH-<CH3COO-<Cl- |
| D、稳定性:H2O>H2S>H2Se |
下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
| B、10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) |
下列化合物中既有离子键又有共价键的是( )
| A、Na2O |
| B、NH4Cl |
| C、H2SO4 |
| D、H2O2 |