题目内容
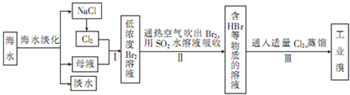
中菲“黄岩岛之争”和“钓鱼岛”危机”凸显了海洋资源的重要性.海水综合利用的工业流程图如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2:
(2)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
考点:海水资源及其综合利用
专题:化学应用
分析:海水淡化后得到NaCl、母液、淡水,电解氯化钠溶液得到氯气,2NaCl+2H2O
2NaOH+Cl2↑+H2↑,将氯气通入母液中发生反应2Br-+Cl2=2Cl-+Br2,溴和二氧化硫发生反应Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入适量氯气蒸馏得到溴单质,再结合物质的性质解答.
| ||
解答:
解:海水淡化后得到NaCl、母液、淡水,电解氯化钠溶液得到氯气,2NaCl+2H2O
2NaOH+Cl2↑+H2↑,将氯气通入母液中发生反应2Br-+Cl2=2Cl-+Br2,溴和二氧化硫发生反应Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入适量氯气蒸馏得到溴单质,
(1)电解NaCl溶液,2NaCl+2H2O
2NaOH+Cl2↑+H2↑,在电解槽中可直接得到的产品有H2和Cl2、NaOH,或H2和NaClO;
故答案为:Cl2;NaOH;NaClO;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素;
故答案为:富集溴元素;
(3)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;生成的两种酸都是强酸,对设备腐蚀较严重,所以要解决的主要问题是设备被腐蚀问题,故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀.
| ||
(1)电解NaCl溶液,2NaCl+2H2O
| ||
故答案为:Cl2;NaOH;NaClO;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素;
故答案为:富集溴元素;
(3)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;生成的两种酸都是强酸,对设备腐蚀较严重,所以要解决的主要问题是设备被腐蚀问题,故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀.
点评:本题考查了海水资源的开发和利用,涉及金属的冶炼、电解原理、氧化还原反应等知识点,根据金属的活动性强弱与冶炼方法的选取、电解原理、物质的性质等知识点来分析解答,注意由带结晶水的氯化镁制取氯化镁的条件,为易错点.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
有一处于平衡状态的反应A(g)+3B(s)?2C(g);△H<0,为了使平衡向生成C的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③加入B物质 ④降低压强 ⑤加入催化剂 ⑥分理出C.
①升高温度 ②降低温度 ③加入B物质 ④降低压强 ⑤加入催化剂 ⑥分理出C.
| A、①③⑤ | B、②④⑥ |
| C、②③⑥ | D、③⑤ |
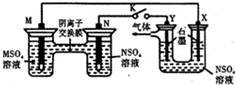 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
在含有I-且能使甲基橙试液变红的溶液中能大量共存的离子组为( )
| A、Fe3+、Na+、Br- |
| B、NH4+、Na+、AlO2- |
| C、Ba2+、Al3+、Cl- |
| D、K+、Mn4-、NO3- |
进行化学实验必须注意安全,下列说法正确的是( )
| A、酒精在实验台上燃烧时,用水扑灭火焰 |
| B、给试管中的液体加热时,试管口不能对着别人 |
| C、大量有毒易燃气体在室内扩散,应立即打开排气扇开关 |
| D、不慎将浓硫酸沾到皮肤上,应用较多的水冲洗,然后涂上硼酸溶液 |

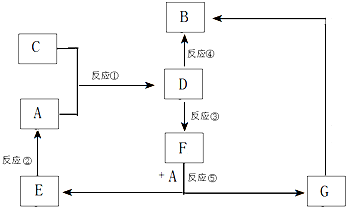 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: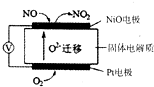 NO2是汽车尾气中的主要污染物之一.
NO2是汽车尾气中的主要污染物之一.