题目内容
下列实验现象描述不正确的是( )
| A、钠在空气中燃烧产生黄色火焰,生成淡黄色固体物质 |
| B、新制氯水呈浅黄绿色,氯水放置数天后pH将变大 |
| C、铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应生成三氯化铁,说明氢离子氧化性比较弱 |
| D、漂白粉的有效成分是次氯酸钙,它具有漂白性是因为在水溶液中生成了有强氧化性的次氯酸 |
考点:氯气的化学性质,氯、溴、碘及其化合物的综合应用,钠的化学性质
专题:卤族元素,几种重要的金属及其化合物
分析:A.Na燃烧生成过氧化钠;
B.氯水放置数天后,发生2HClO
2HCl+O2↑;
C.同种还原剂与不同氧化剂反应,变价金属的价态越高,则氧化剂的氧化性越强;
D.HClO具有漂白性.
B.氯水放置数天后,发生2HClO
| ||
C.同种还原剂与不同氧化剂反应,变价金属的价态越高,则氧化剂的氧化性越强;
D.HClO具有漂白性.
解答:
解:A.Na燃烧生成过氧化钠,其焰色为黄色,生成物为淡黄色固体,故A正确;
B.氯水放置数天后,发生2HClO
2HCl+O2↑,则酸性增强,pH减小,故B错误;
C.同种还原剂与不同氧化剂反应,变价金属的价态越高,则氧化剂的氧化性越强,所以铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应生成三氯化铁,则氯气得到电子的能力强,说明氢离子氧化性比较弱,故C正确;
D.HClO具有漂白性,所以漂白粉具有漂白性是因为有效成分次氯酸钙在水溶液中生成了有强氧化性的次氯酸,故D正确;
故选B.
B.氯水放置数天后,发生2HClO
| ||
C.同种还原剂与不同氧化剂反应,变价金属的价态越高,则氧化剂的氧化性越强,所以铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应生成三氯化铁,则氯气得到电子的能力强,说明氢离子氧化性比较弱,故C正确;
D.HClO具有漂白性,所以漂白粉具有漂白性是因为有效成分次氯酸钙在水溶液中生成了有强氧化性的次氯酸,故D正确;
故选B.
点评:本题考查氯气的化学性质,为高频考点,综合考查元素化合物知识,把握发生的反应及有关的反应原理为解答的关键,选项C中氧化性的比较为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
若49g H2SO4含有的O原子数为N,则阿佛加德罗常数(NA)等于( )
| A、0.25N mol |
| B、0.5N mol-1 |
| C、N 个 |
| D、2N L/mol |
实验操作的规范是实验的基本要求.下列实验操作正确的是( )
A、 |
B、 |
C、 |
D、 |
下面实验操作不能实现实验目的是( )
| A、鸡蛋白溶液中,加入浓的硫酸铵溶液有沉淀析出,加入水后沉淀溶解 |
| B、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| C、取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品 |
| D、取少量淀粉溶液,加入一定量稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热,观察现象,判断淀粉的水解的产物中是否含有葡萄糖 |
下列说法正确的是( )
A、如图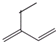 有机化合物主链5个C原子 有机化合物主链5个C原子 |
B、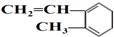 与Br2发生1:1加成反应的产物有6种 与Br2发生1:1加成反应的产物有6种 |
| C、苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 |
D、丁苯橡胶结构如下,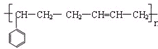 其单体均为烯烃 其单体均为烯烃 |
一种二肽的结构简式为: ,合成这种二肽的氨基酸( )
,合成这种二肽的氨基酸( )
 ,合成这种二肽的氨基酸( )
,合成这种二肽的氨基酸( )A、 和 和 |
B、 |
C、 |
D、 和 和 |
下列离子方程式正确的是( )
| A、溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| B、向NaAlO2溶液中通入过量的CO2有白色沉淀:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
| C、漂白液和强酸性洗涤剂混合使用:Cl-+ClO-+2H+=Cl2↑+H2O |
| D、少量碳酸氢镁与Ca(OH)2悬浊液混合:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32 |
| D、把H2O2滴入FeCl2溶液中,溶液由浅绿色变为棕黄色,证明H2O2有还原性 |