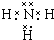题目内容
4.将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述正确的是( )
| A. | 锌片做负极,锌发生还原反应 | B. | 铜片做正极,铜得电子 | ||
| C. | 溶液中的pH值减小 | D. | 铜片上有气泡冒出 |
分析 锌比铜活泼,锌为负极,被氧化,发生Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,溶液中阳离子向正极移动,以此解答该题.
解答 解:A.锌比铜活泼,锌为负极,被氧化,发生氧化反应,故A错误;
B.锌比铜活泼,锌为负极,铜为正极,电极周围氢离子得电子,故B错误;
C.电池的总反应为:Zn+2H+═H2↑+Zn2+,反应消耗氢离子,则溶液中的pH值增大,故C错误;
D.溶液中的H+向正极移动,氢离子在铜上放电生成氢气,故D正确.
故选:D.
点评 本题综合考查了原电池知识,侧重于学生的分析能力的考查,注意把握原电池反应原理和两极变化,明确原电池放电时电极方程式的书写是解本题的关键,难度不大.

练习册系列答案
相关题目
15.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,增大压强体系颜色变深 | |
| D. | SO2催化氧化成SO3的反应,往往需要使用催化剂 |
19.1mol某烃最多能和1molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和Cl2发生取代反应最多生成9molHCl,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
| A. | CH3-CH═CH-CH2-CH3 | B. | CH2═CH-CH═CH2 | ||
| C. | CH3═CH-CH3 | D. | CH3-CH═CH-CH3 |
16.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:通入氢气让乙烯充分反应;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:通入氢气让乙烯充分反应;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
13.下列说法正确的是( )
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 | |
| D. | 石油裂化的主要目的是为了提高轻质油的质量和产量 |
14.下列说法正确的是( )
| A. | 摩尔是一种物理量 | B. | Cl2的摩尔质量是71g | ||
| C. | 1molO2的体积是22.4L | D. | 36gH2O含有的分子数为2NA |
 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: