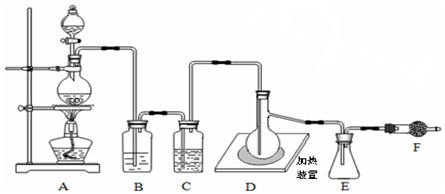
题目内容
11.现要把SO42-、CO32-、H+、OH-、NH4+、Fe3+和Na+分为两组混合溶液,每组含有4种离子.若该组混合溶液的pH>7,则混合溶液中含有的离子是:SO42-、CO32-、OH-、Na+若该组混合溶液的pH<7,则混合溶液中含有的离子是H+、NH4+、Fe3+、SO42-.分析 分为两组混合溶液,每组含有4种离子.若该组混合溶液的pH>7,则溶液显碱性,一定含OH-,则该组离子不含H+、NH4+、Fe3+,且CO32-、Fe3+相互促进水解不能共存,结合溶液不显电性来解答.
解答 解:H+、OH-结合生成水不能大量共存,则离子分为两组,溶液分别显碱性、酸性,
CO32-、H+结合生成水和气体,不能大量共存;
CO32-、Fe3+相互促进水解不能共存;
OH-分别与NH4+、Fe3+反应不能共存,
溶液不显电性,
每组含有4种离子,该组混合溶液的pH>7,该组离子为SO42-、CO32-、OH-、Na+;
若该组混合溶液的pH<7,则混合溶液中含有的离子为SO42-、CO32-、OH-、Na+,
故答案为:SO42-、CO32-、OH-、Na+;H+、NH4+、Fe3+、SO42-.
点评 本题考查离子的检验及离子共存,为高频考点,把握离子之间的反应、溶液不显电性为解答的关键,侧重分析与应用能力的考查,注意各含4种离子,题目难度不大.

练习册系列答案
相关题目
2.工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质) 回收铜和铬等金属,回收流程如图1:
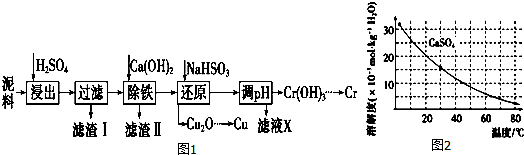
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
6.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
①该反应能发生的理由是温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下四种物质中K2Cr2O7的溶解度最小,利用复分解反应在低温下可以得到重铬酸钾.
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
3.下列反应能用H++OH-═H2O 表示的是( )
| A. | NaOH 溶液和CO2 的反应 | B. | Ba(OH)2 溶液和稀H2SO4 的反应 | ||
| C. | NaHSO4溶液和KOH 反应 | D. | 石灰乳和稀H2SO4 的反应 |
20.下列仪器及其名称不正确的是( )
| A. |  蒸馏烧瓶 | B. |  分液漏斗 | C. |  蒸发皿 | D. |  溶量瓶 |
18.某温度,在1L恒容密闭容器中,加入10molCO、7molH2S,发生如下反应:CO(g)+H2S(g)?COS(g)+H2(g),达平衡时CO物质的量为8mol,下列说法正确的是( )
| A. | 该温度下,化学平衡常数K=0.1 | |
| B. | H2S的平衡转化率为20% | |
| C. | 增大CO浓度,平衡正向移动,可以提高CO的转化率 | |
| D. | 升高温度,H2S浓度增加,表明该反应正方向是吸热反应 |
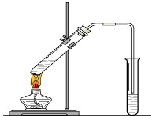 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: