题目内容
氧化钠和过氧化钠总质量14g,通入足量的二氧化碳后质量变为21.2g,求原混合物中二者的物质的量之比.
考点:有关混合物反应的计算
专题:计算题
分析:Na2O、Na2O2混合物通入足量CO2,反应得到21.2g为Na2CO3的质量,由钠元素守恒可知n(Na2O)+n(Na2O2)=n(Na2CO3),根据Na2O、Na2O2的总物质的量、总质量列方程计算Na2O、Na2O2的物质的量,进而计算二者物质的量之比.
解答:
解:Na2O、Na2O2混合物通入足量CO2,反应得到21.2g为Na2CO3的质量,由钠元素守恒可知n(Na2O)+n(Na2O2)=n(Na2CO3)=
=0.2mol,
设Na2O、Na2O2的物质的量分别为xmol、ymol,则:
解得x=0.1 y=0.1
故混合物中Na2O、Na2O2的物质的量之比为0.1mol:0.1mol=1:1,
答:原混合物中Na2O、Na2O2的物质的量之比为1:1.
| 21.2g |
| 106g/mol |
设Na2O、Na2O2的物质的量分别为xmol、ymol,则:
|
解得x=0.1 y=0.1
故混合物中Na2O、Na2O2的物质的量之比为0.1mol:0.1mol=1:1,
答:原混合物中Na2O、Na2O2的物质的量之比为1:1.
点评:本题考查混合物计算,难度中等,关键是根据钠元素守恒确定Na2O、Na2O2的总物质的量.

练习册系列答案
相关题目
下列电离方程式中,书写错误的是( )
| A、Na2CO3=Na++CO32- |
| B、Ba(OH)2=Ba2++2OH- |
| C、H2SO4=2H++SO42- |
| D、KCl=K++Cl- |
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3-0.5n]m,制备过程如图所示:下列说法不正确的是( )


| A、炉渣中FeS与硫酸和氧气的反应式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O |
| B、气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 |
| C、溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 |
| D、向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |
 由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:
由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:
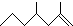 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.