题目内容
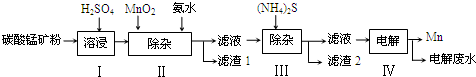
 由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:
由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:(1)当温度T<T0时,v正
(2)当温度T=T0时,v正
(3)该反应的正反应是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据图象可知,T0时Z%达到最大,说明此时处于平衡状态,则:v正=v逆,所以当温度T<T0时,反应向着正向移动,v正>v逆;
当温度T>T0时,Z%减小,说明平衡向着逆向移动,该反应一定为放热反应.
当温度T>T0时,Z%减小,说明平衡向着逆向移动,该反应一定为放热反应.
解答:
解:(1)T0时Z%达到最大,说明此时处于平衡状态,则:v正=v逆,所以当温度T<T0时,反应向着正向移动,v正>v逆,
故答案为:>;
(2)当温度T=T0时,根据图象可知,T0时Z%达到最大,说明此时处于平衡状态,则:v正=v逆,
故答案为:=;
(3)根据图象曲线变化可知,当温度T>T0时,Z%减小,说明平衡向着逆向移动,逆反应方向为吸热反应,则该反应一定为放热反应,
故答案为:达到平衡状态后升高温度,Z%减小,说明平衡向着逆向移动,逆反应为吸热反应,则正反应为放热反应.
故答案为:>;
(2)当温度T=T0时,根据图象可知,T0时Z%达到最大,说明此时处于平衡状态,则:v正=v逆,
故答案为:=;
(3)根据图象曲线变化可知,当温度T>T0时,Z%减小,说明平衡向着逆向移动,逆反应方向为吸热反应,则该反应一定为放热反应,
故答案为:达到平衡状态后升高温度,Z%减小,说明平衡向着逆向移动,逆反应为吸热反应,则正反应为放热反应.
点评:本题考查了化学平衡及其影响,题目难度中等,注意掌握化学平衡状态及其影响,正确判断图象中的平衡状态为解答关键,试题充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
某溶液灼烧时,透过蓝色钴玻璃看到紫色火焰,下列判断中错误的是( )
| A、该溶液中不可能含钾单质 |
| B、该溶液中不可能含钠的化合物 |
| C、该溶液中一定含钾元素 |
| D、该溶液中可能含钠的化合物 |
等质量的C72和C60,下列说法正确的是( )
| A、物质的量相等 |
| B、分子个数相等 |
| C、原子个数相等 |
| D、以上说法都不正确 |
你认为减少酸雨的产生可采取的措施是( )
①用煤作燃料 ②把工厂烟囱造高 ③化石燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源.
①用煤作燃料 ②把工厂烟囱造高 ③化石燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源.
| A、①②③ | B、②③④⑤ |
| C、③⑤ | D、①③④⑤ |
下列现象或者性质与胶体的性质无关的是( )
| A、同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 |
| B、江河入海口,容易形成沙洲 |
| C、医学上治疗肾衰竭等疾病时,血液的净化手段利用血液透析 |
| D、向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
下列离子方程式正确的是( )
| A、向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B、向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、醋酸和氨水混合:CH3COOH+OH-=CH3COO-+H2O |
| D、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |