题目内容
11.四川攀枝花蕴藏丰富的钒、钛、铁资源.用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下: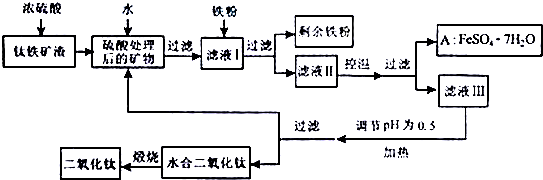
(1)硫酸与二氧化钛反应的化学方程式是TiO2+2H2SO4=Ti(SO4)2+2H2O.
(2)向滤液I中加入铁粉,发生反应的离子方程式为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑.
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解.水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀.用所学化学平衡原理分析通入高温水蒸气的作用加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解.过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、H2O、FeSO4、H2SO4(填化学式),减少废物排放.
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料.若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料160a+320b+160ckg.
分析 (1)依据流程分析,硫酸与二氧化钛反应是发生的复分解反应;
(2)钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料溶解于硫酸过滤后得到滤液中含有铁离子、亚铁离子、过滤的硫酸,加入铁粉和铁离子反应,和酸反应;
(3)影响钛盐水解的因素有浓度、温度等,由Ti(SO4)2水解呈酸性,知沸水、高温水蒸气、维持溶液沸腾等均为升温,沸水、高温水蒸气即加水且降低H+浓度,故高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解;
(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol加入适量氢氧化钠溶液恰好完全反应.,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A,和2c×103mol的铁.根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,.而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合.可知消耗铁离子为8b×103mol,根据铁元素守恒;
解答 解:(1)依据酸的通性,可以与金属氧化物反应,又知道TI的化合价,可以写出化学方程式为:TiO2+2H2SO4=Ti(SO4)2+2H2O,
故答案为:;
(2)加入浓硫酸后,浓硫酸可以氧化亚铁离子,再加入铁粉,铁粉可以还原铁离子,铁粉还可以与溶液中的H+反应,反应的离子方程式为:Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑,
故答案为:Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
(3)影响钛盐水解的因素有浓度、温度等,由Ti(SO4)2水解呈酸性,知沸水、高温水蒸气、维持溶液沸腾等均为升温,沸水、高温水蒸气即加水且降低H+浓度,故高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解.根据该工艺流程知:滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等.
故答案为:加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解;H2O; FeSO4; H2SO4;
(4)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103mol,可知加入氢氧化钠为4a×103mol;后来又加入12b×103mol的A和2c×103mol的铁,由Na2SO4 、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为2a×103mol;利用SO42-离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(2a+12b-2a)×103mol×$\frac{1}{3}$=4b×103mol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2 n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(2a+12b+2c-4b×2)×103mol×$\frac{1}{2}$=(a+2b+c)×103mol,计算得m(Fe2O3)=(160a+320b+160c)kg,
故答案为:160a+320b+160c.
点评 本题考查制备方案的设计,题目难度中等,注意解答化工工艺流程题要全面分析理解流程中各个步骤各有何作用(即各工艺流程的目的是什么)、依次涉及何种反应原理、原料、产品、杂质、副产品等成分是什么、这些物质间如何进行转化等,在此基础上,根据各设问,步步深入,进行快速解答,试题培养了学生的分析能力及化学实验能力.

| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
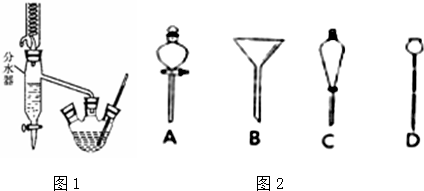
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
| A. | 1:1 | B. | 1:2 | C. | 5:7 | D. | 7:5 |
| A. | 稀醋酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液反应:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸钙与足量盐酸反应:CO32-+2H+═H2O+CO2↑ |
| A. | 0.8mol/(L•s) | B. | 2.0mol/(L•s) | C. | 4.0mol/(L•s) | D. | 6.0mol/(L•s) |
| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中H+的个数增大 | D. | Kw的值减小 |
| A. | 定容时俯视液面 | B. | 未洗涤烧杯和玻璃棒 | ||
| C. | 容量瓶未干燥 | D. | 转移溶液前溶液未冷却至室温 |