题目内容
7.下列离子方程式,正确的是( )| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| C. | 将Fe2O3溶于氢碘酸中Fe2O3+6H+═2Fe3++3H2O | |
| D. | 等物质的量的溴化亚铁跟氯气反应2Fe2++2Br-+2Cl2═2F3++Br2+4Cl- |
分析 A.氢氧化钠少量先反应氢离子;
B.二者反应生成亚硫酸钡、氢氧化钠和水;
C.三价铁离子能够氧化碘离子生成单质碘;
D.等物质的量的溴化亚铁跟氯气反应,铁离子全部被氧化,溴离子一半被氧化.
解答 解:A.硫酸氢铵和氢氧化钠等物质的量混合,离子方程式:H++OH-═H2O,故A错误;
B.向Ba(OH)2溶液中加入少量NaHSO3溶液,离子方程式:HSO3-+Ba2++OH-═BaSO3↓+H2O,故B错误;
C.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2;故C错误;
D.等物质的量的溴化亚铁跟氯气反应,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应的实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
18.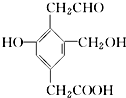 某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )
某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )
 某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )
某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )| A. | 4:3:2:1 | B. | 3:3:2:1 | C. | 4:3:2:2 | D. | 3:3:2:2 |
15.合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A. | 不锈钢 | B. | 硫酸铝钾 | C. | 青铜 | D. | 硬铝 |
2.在盐类水解的过程中,下列说法正确的是( )
| A. | 盐的电离平衡被破坏 | B. | 水的电离程度一定会增大 | ||
| C. | 溶液的pH一定会增大 | D. | c(H+)与c(OH-)的乘积一定会增大 |
16.下列物质存放方法错误的是( )
| A. | 金属钠存放于煤油中 | |
| B. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| C. | 铝片置于广口瓶中保存 | |
| D. | 将1mol/L的NaCl溶液保存在容量瓶中 |
17.下列反应中,生成物的总能量大于反应物总能量的是( )
| A. | 氢气在氧气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl固体的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 过氧化钠与水反应产生氧气 |
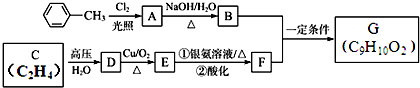
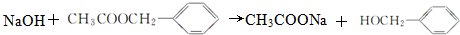 .
. 、
、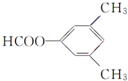 .
.