题目内容
17.下列反应中,生成物的总能量大于反应物总能量的是( )| A. | 氢气在氧气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl固体的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 过氧化钠与水反应产生氧气 |
分析 生成物的总能量大于反应物总能量,反应为吸热反应,常见吸热反应有:绝大多数的分解反应、以C、CO、H2等物质做还原剂的氧化还原反应、Ba(OH)2•8H2O与NH4Cl固体的反应等,以此解答该题.
解答 解:生成物的总能量大于反应物总能量,反应为吸热反应.
A、所有的燃烧均为放热反应,故氢气在氧气中的燃烧是放热的,故A错误;
B、Ba(OH)2•8H2O与NH4Cl固体的反应为吸热反应,故B正确;
C、金属与酸或水的反应为放热反应,故C错误;
D、过氧化钠与水反应生成氧气的反应为放热反应,故D错误.
故选B.
点评 本题考查反应热与焓变知识,题目难度不大,注意常见吸热反应与放热反应,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
7.下列离子方程式,正确的是( )
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| C. | 将Fe2O3溶于氢碘酸中Fe2O3+6H+═2Fe3++3H2O | |
| D. | 等物质的量的溴化亚铁跟氯气反应2Fe2++2Br-+2Cl2═2F3++Br2+4Cl- |
8.人体血液中存在的平衡:H2CO3 $?_{H+}^{OH-}$H+OH-HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随 $\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$变化关系如表所示,则下列说法中正确的是( )
| $\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$ | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7的血液中,c(HCO3-)=c(H2CO3) | |
| B. | 正常体温下人体发生碱中毒时,c(H+)•c(OH-)变大 | |
| C. | 人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | |
| D. | $\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=20.0时,H2CO3的电离程度大于HCO3-的水解程度 |
5.某同学在实验室中用KMnO4代替MnO2制备Cl2,反应原理为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列叙述不正确的是( )
| A. | 氧化剂为KMnO4,其中Cl元素被还原 | |
| B. | 若有0.8molH2O生成,则反应中有NA个电子转移 | |
| C. | 浓HCl在反应中起酸性和还原性的作用 | |
| D. | 氧化剂与还原剂的物质的量之比为1:5 |
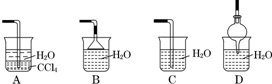
12.能用如图装置进行喷泉实验的气体是( )


| A. | CO2 | B. | CO | C. | O2 | D. | NO |
2.一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ,经测定反应中转移的电子数与74.75克金属钠与水反应转移的电子数相同.则此条件下反应:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2 (g)+5H2O(g)的△H为( )
| A. | -8Q kJ•mol-1 | B. | +16Q kJ•mol-1 | C. | +8Q kJ•mol-1 | D. | -16Q kJ•mol-1 |
14.下列物质中不属于碱性氧化物,但能与酸反应且有盐生成的是( )
| A. | Na2O | B. | Fe2O3 | C. | Na2O2 | D. | CO2 |