题目内容
5.下表为元素周期表前四周期的一部分,其中的编号代表对应的元素.| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||
| ⑨ | ⑩ |
 ;
;(2)由元素⑩⑤⑦组成一种原子个数比为1:5:5的配位化合物,该物质常温下呈液态,熔点为20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断:该化合物的晶体中存在的作用力有BDF;
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(3)元素⑤⑥⑦⑧的第一电离能由大到小的顺序是(用元素符号表示)F>N>O>C,元素①分别与⑤⑥⑦形成最简单的常见化合物分子甲、乙和丙.下列有关叙述不正确的有CD;
A.甲、乙和丙分子的空间构型分别为正四面体型、三角锥形、V型
B.甲、乙和丙分子中,中心原子的杂化类型均为sp3
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(4)元素①④⑦能形成原子个数比为3:1:3的一元含氧酸,该酸能溶于水且能促进水的电离,此过程生成的离子中④原子满足最外层8电子的稳定结构,请写出该酸溶于水时的电离方程式H3BO3+H2O?[B(OH)4]-+H+;
(5)②、③均是金属元素,可分别与⑦形成同种类型的晶体Ⅰ和晶体Ⅱ,二者熔点如表所示.试指出后者熔点比前者高出许多的原因:BeO、Li2O均形成离子晶体,Be2+离子所带电荷比Li+离子的高,且半径比Li+离子的小,故BeO的晶格能比Li2O的晶格能大;
| 晶体Ⅰ | 晶体Ⅱ | |
| 熔点/K | 1840 | 2803 |
分析 由元素在周期表中位置,可知①为H、②为Li、③为Be、④为B、⑤为C、⑥为N、⑦为O、⑧为F、⑨为Cr、⑩为Fe.
(1)表中元素⑩为Fe,价电子排布式为3d64s2,根据泡利原理、洪特规则画出价层电子排布图;
(2)由元素⑩⑤⑦组成一种原子个数比为1:5:5的配位化合物为Fe(CO)5,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体;
(3)同周期随原子序数增大元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
元素①分别与⑤⑥⑦形成最简单的常见化合物分子甲为CH4、乙为NH3、丙为H2O;
(4)元素①④⑦能形成原子个数比为3:1:3的一元含氧酸为H3BO3,该酸能溶于水且能促进水的电离,能与水电离的氢氧根离子结合,此过程生成的离子中④原子满足最外层8电子的稳定结构,生成的离子为[B(OH)4]-;
(5)均形成离子晶体,离子电荷越高、半径越小,晶格能越大,晶体熔点越高;
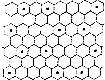
(6)六个K原子形成正六边形,利用均摊法计算正六边形中C、K原子数目,确定该层化合物的化学式.
解答 解:由元素在周期表中位置,可知①为H、②为Li、③为Be、④为B、⑤为C、⑥为N、⑦为O、⑧为F、⑨为Cr、⑩为Fe.
(1)表中元素⑩为Fe,价电子排布式为3d64s2,根据泡利原理、洪特规则,价层电子排布图为: ,
,
故答案为: ;
;
(2)由元素⑩⑤⑦组成一种原子个数比为1:5:5的配位化合物为Fe(CO)5,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体,分子之间存在范德华力,Fe与CO之间形成配位键,CO分子中含有极性键,
故选:BDF;
(3)同周期随原子序数增大元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能F>N>O>C;
元素①分别与⑤⑥⑦形成最简单的常见化合物分子甲为CH4、乙为NH3、丙为H2O.
A.甲烷、氨气和水分子的空间构型分别为正四面体型、三角锥形、V型,故A正确;
B.甲、乙和丙分子中,中心原子的杂化轨道数目均为4,类型均为sp3,故B正确;
C.孤对电子之间排斥力>孤对电子与成键电子对排斥力,三种分子中键角由大到小的顺序:甲烷>氨气>水,故C错误;
D.甲烷为正四面体对称结构,属于非极性分子,故D错误,
故答案为:F>N>O>C;CD;
(4)元素①④⑦能形成原子个数比为3:1:3的一元含氧酸为H3BO3,该酸能溶于水且能促进水的电离,能与水电离的氢氧根离子结合,此过程生成的离子中④原子满足最外层8电子的稳定结构,生成的离子为[B(OH)4]-,该酸溶于水时的电离方程式为:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(5)BeO、Li2O均形成离子晶体,Be2+离子所带电荷比Li+离子的高,且半径比Li+离子的小,故BeO的晶格能比Li2O的晶格能大,故BeO的熔点高,
故答案为:BeO、Li2O均形成离子晶体,Be2+离子所带电荷比Li+离子的高,且半径比Li+离子的小,故BeO的晶格能比Li2O的晶格能大;
(6)六个K原子形成正六边形,正六边形中C原子数目为24、K原子数目=6×$\frac{1}{3}$=2,C、K原子数目之比为24:2=12:1,该层化合物的化学式为KC12,
故答案为:KC12.
点评 本题是对物质结构与性质的考查,涉及元素周期表、核外电子排布、电离能、配合物、化学键、空间构型与杂化方式判断、分子极性、晶体类型与性质、晶胞计算等,是对物质结构主干知识的综合考查,需学生具备扎实的基础与灵活运用能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1molCH5+与1molNH2-所含电子数均为10NA | |
| B. | 60gSiO2晶体中所含[SiO4]四面体数为0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-数为1×10-4NA | |
| D. | 标准状况下,22.4LCO、NO混合气体中所含氧原子数为2NA |
| A. | 铁螺丝连接锌板时,铁不容易生锈 | |
| B. | 反应CaC03(s)=Ca0(s)+C02(g)在常温下不能发生,则该反应的△H<0 | |
| C. | pH=11的NaOH溶液与pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数小于0.5×6.02×1023 |
 如图表示某有机反应,该反应的类型是( )
如图表示某有机反应,该反应的类型是( )| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 聚合反应 |
| A. | 保持容器容积不变,向其加入1molH2(g),反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率一定加快 |
| A. | 有共用电子对偏移 | |
| B. | 有电子得失 | |
| C. | 既有电子得失,又有共用电子对偏移 | |
| D. | 存在共价键 |
| A. | 合成洗涤剂 | B. | 合成纤维 | C. | 合成橡胶 | D. | 塑料 |
| A. | NaH是氧化剂 | B. | H2O是氧化剂 | ||
| C. | 氧化剂与还原剂的质量比为1:1 | D. | 每生成1molH2转移2mol电子 |
 .
.