题目内容
3.W、X、Y、Z为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和 为22,W与Y同主族,W2-具有与氖原子相同的电子层结构,下列说法正确的是( )| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物YW2具有强氧化性 | D. | 化合物YW2中只含共价键 |
分析 W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W2-具有与氖原子相同的电子层结构,则W为O元素;W与Y同主族,Y为S元素,结合原子序数可知Z只能为Cl,它们的最外层电子数之和为22,X的最外层电子数为22-6-6-7=3,结合原子序数可知X为Al,以此来解答.
解答 解:由上述分析可知,W为O,X为Al,Y为S,Z为Cl,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Y>W>X,故A错误;
B.非金属性W>Z>Y,则单质的氧化性为W>Z>Y,故B错误;
C.SO2中S为+4价,为中间价,具有氧化性和还原性,故C错误;
D.SO2中只有S、O之间的共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
13.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| A. | 1.1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
14.下列关于物质分类的说法正确的是( )
| A. | BaSO4的水溶液不易导电,故BaSO4是非电解质 | |
| B. | 烧碱、纯碱、盐酸均为电解质 | |
| C. | 金刚石、石墨均属于单质 | |
| D. | 溶液导电性强弱只取决于溶液中所含离子浓度的大小 |
18.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 石油分馏的目的是获得乙烯、丙烯和丁二烯 | |
| B. | 减少SO2的排放,可以从根本上消除雾霾 | |
| C. | 食品工业利用液态二氧化碳代替有机溶剂,能避免有机溶剂污染食品 | |
| D. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 |
8.下列实验对应的现象及结论均正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
15.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 配制100mL 0.1000mol•L-1H2SO4溶液 | 用量筒量取20mL 0.5000mol•L-1H2SO4溶液于烧杯中,加水80mL |
| B | 除去Cl2中混有的少量HCl | 将Cl2与HCl混合气体通过饱和NaHCO3溶液 |
| C | 除去KNO3固体中混杂的少量NaCl | 将混合物固体制成热的饱和溶液,冷却结晶,过滤 |
| D | 验证稀硝酸能将Fe氧化为Fe3+ | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硫酸和碳酸钠反应生成的气体通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| D | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸 的酸性比硫酸强 |
| A. | A | B. | B | C. | C | D. | D |
17.现有20g下列四种物质,其中物质的量最大的是( )
| A. | H2O | B. | H2 | C. | N2 | D. | O2 |
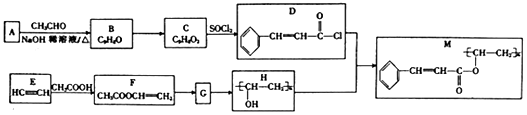
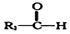 +
+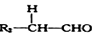 $→_{△}^{NaOH稀溶液}$
$→_{△}^{NaOH稀溶液}$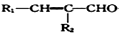 +H2O(R1、R2为羟基或氯)
+H2O(R1、R2为羟基或氯) .
. .
.