题目内容
13.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )| A. | 1.1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
分析 已知:还原性强弱:I->Fe2+,所以氯气先氧化碘离子,再氧化亚铁离子,根据离子方程式计算.
解答 解:已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有一半的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+2Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=cV=0.1cmol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol解得:c=1.2mol/L,
故选C.
点评 本题主要考查学生氧化还原反应的有关计算,注意溶液中离子反应的顺序,根据离子方程式计算,难度不大.

练习册系列答案
相关题目
17.下列反应的离子方程式书写正确的是( )
| A. | 锌与CH3COOH溶液反应:Zn+2H+═Zn2++H2↑ | |
| B. | 氢氧化铝与稀硝酸反应:H++OH-═H2O | |
| C. | CuCl2溶液与铁粉反应:3Cu2++2Fe═3Cu+2Fe3+ | |
| D. | MgCl2溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ |
18.短周期主族元素甲、乙、丙、丁、戊的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,在中学常见的酸中戊的最髙价氧化物对应的水化物的酸性最强.下列叙述错误的是( )
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
1.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl△H=QKJ•mol-1.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据(不考虑副反应)
(1)110℃时平衡常数1
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
18.下列离子方程式正确的是( )
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
5.下列说法正确的是( )
| A. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| B. | 把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳 | |
| C. | 取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子 | |
| D. | 不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来 |
2.下表各组物质中,物质之间不可能实现如图所示转化的是( )

| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | NaCO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
3.W、X、Y、Z为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和 为22,W与Y同主族,W2-具有与氖原子相同的电子层结构,下列说法正确的是( )
| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物YW2具有强氧化性 | D. | 化合物YW2中只含共价键 |
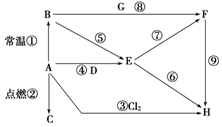 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.