题目内容
8.下列实验对应的现象及结论均正确,且两者具有因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu与稀硫酸不反应,硝酸盐在酸性条件下与Cu发生氧化还原反应;
B.氧化铝的熔点高,包裹在Al的外面;
C.Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低,平衡Fe3++3SCN-?Fe(SCN)3向逆反应方向移动;
D.用NaOH溶液滴定醋酸溶液,酚酞作试剂,开始为无色,滴定终点时为粉红色,达到滴定终点.
解答 解:A.Cu与稀硫酸不反应,硝酸盐在酸性条件下与Cu发生氧化还原反应,生成NO气体,结论不合理,故A错误;
B.氧化铝的熔点高,包裹在Al的外面,则铝熔化,但熔化的铝不滴落,故B正确;
C.Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低,平衡Fe3++3SCN-?Fe(SCN)3向逆反应方向移动,则有红褐色沉淀生成,故C错误;
D.用NaOH溶液滴定醋酸溶液,酚酞作试剂,开始为无色,滴定终点时为粉红色,达到滴定终点,反应生成醋酸钠水解显碱性,NaOH不过量,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、平衡移动、中和滴定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
19. 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应.
(2)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(3)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是由于该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(4)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(5)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:
N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应.
(2)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(3)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是由于该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(4)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(5)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:
N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
16.设NA为阿伏伽德罗常数的值.已知乙烯和环丙烷(C3H6)组成的混合气体的质量为28g,下列对该混合气体的说法错误的是( )
| A. | 混合气体中含有的碳碳双键数为NA | |
| B. | 混合气体中含有的碳原子数为2NA | |
| C. | 当混合气体完全燃烧时,消耗O2的分子数为3NA | |
| D. | 当混合气体完全燃烧时,转移的电子数为12NA |
3.W、X、Y、Z为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和 为22,W与Y同主族,W2-具有与氖原子相同的电子层结构,下列说法正确的是( )
| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物YW2具有强氧化性 | D. | 化合物YW2中只含共价键 |
13.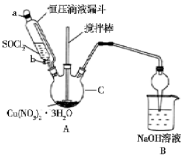 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
(1)铜与稀HNO3反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
20.下列离子组能以较大浓度共存的是( )
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
1.实验室从溴水中提取溴单质的操作,正确的是( )
| A. | 分液、蒸馏 | B. | 过滤、蒸发 | C. | 萃取、分液、蒸馏 | D. | 萃取、分液 |
2.下列物质中,不能由两种单质直接化合得到的是( )
| A. | HCl | B. | Na2O2 | C. | MgO | D. | FeCl2 |