题目内容
为测定氨分子中氮、氢原子个数比,设计了如下实验流程:

任写一个制取氨气的化学方程式 .干燥氨气的常用药剂是 .足量氨气与氧化铜加热反应的化学方程式为 .洗气瓶中浓硫酸的作用是 .

任写一个制取氨气的化学方程式
考点:氨的化学性质,氨的实验室制法,探究物质的组成或测量物质的含量
专题:实验设计题
分析:利用氯化铵固体和氢氧化钙固体加热反应生成氨气,通过碱石灰的干燥管干燥氨气,通过装有氧化铜的硬质玻璃管发生反应生成氮气、铜和水,通过浓硫酸的洗气瓶干燥气体,最后用排水量气法测定生成氮气的体积,结合浓硫酸增重的水的质量和氮气体积计算氢元素和氮元素物质的量之比,得到氨气中氢元素原子数和氮原子数之比.
解答:
解:利用氯化铵固体和氢氧化钙固体加热反应生成氨气,2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2,通过碱石灰的干燥管干燥氨气,通过装有氧化铜的硬质玻璃管发生反应生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO
N2↑+3H2O+3Cu,通过浓硫酸的洗气瓶干燥气体,最后用排水量气法测定生成氮气的体积,结合浓硫酸增重的水的质量和氮气体积计算氢元,和氮元素物质的量之比,得到氨气中氢元素原子数和氮原子数之比;
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;碱石灰;2NH3+3CuO
N2↑+3H2O+3Cu;吸收气体中的水蒸气.
| ||
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
| ||
点评:本题考查了氨气制备和盐酸原子数的实验测定方法和性质的理解应用,主要是浓硫酸吸收生成的水蒸气,排水法测定生成氮气的体积,掌握实验基本操作是解题关键,题目较简单.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列说法不正确的是( )
| A、漂白精的有效成分是Ca(ClO)2 |
| B、利用高纯硅的半导体性能,可以制成光电池 |
| C、NO、NO2是大气污染物,能在空气中稳定存在 |
| D、HCl、NH3、BaSO4都是电解质 |
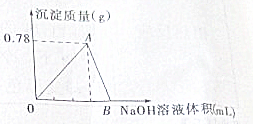 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示: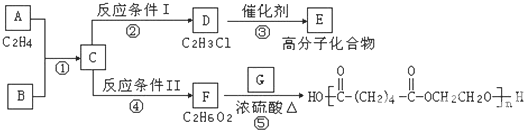
 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):



 和
和 ,鉴别I和J的试剂为
,鉴别I和J的试剂为 )制得.请写出以L为原料制得M的合成路线流程图(无机试剂任用).流程图示例如下:
)制得.请写出以L为原料制得M的合成路线流程图(无机试剂任用).流程图示例如下: )→
)→