题目内容
20.核内中子数为N的R2+离子,质量数为A,则n克它的氧化物中所含质子的物质的量是( ) 摩尔.| A. | $\frac{n(A-N+8)}{A+16}$ | B. | $\frac{n(A-N+10)}{(A+16)}$ | C. | A-N+2 | D. | $\frac{n(A-N+6)}{A}$ |
分析 核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,根据n=$\frac{m}{M}$计算ng该氧化物的物质的量,一个氧化物分子中含有(A-N+8)个质子,据此进行计算.
解答 解:R2+离子对应的氧化物为RO,该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为:$\frac{ng}{(A+16)g/mol}$=$\frac{n}{A+16}$mol,
一个氧化物分子中含有(A-N+8)个质子,所以ng 它的氧化物中所含质子的物质的量为:$\frac{n}{A+16}$mol×(A-N+8)=$\frac{n}{A+16}$(A-N+8)mol,
故选A.
点评 本题考查物质的量的计算,题目难度不大,明确质子数、中子数、质量数之间的关系为解答关键,注意质量数在数值上等于其相对原子质量,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.工业上制备 Cu(NO3)2•6H2O的流程如下:
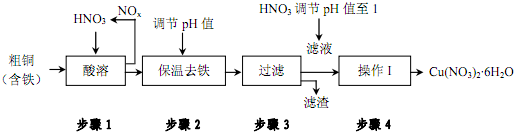
(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
(3)步骤3中,要用硝酸调节溶液的pH=1,应用平衡原理解释其原因为硝酸铜水解生成氢氧化铜和硝酸,加入硝酸抑制硝酸铜水解,得到较纯净的Cu(NO3)2•6H2O
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
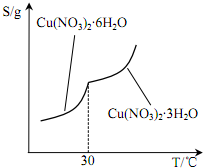
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.

(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.

8.钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切.
(1)元素的性质特别是化学性质取决于元素原子结构.钠离子的电子式为Na+,铝元素的原子结构示意图为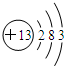 .
.
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+(用离子符号表示).在短周期中非金属性最强的元素位于第二周期第VIIA族.
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律.下列有关说法正确的是b、d(选填编号).
a.元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性.第三周期主族元素的电负性如下:
从上表可以看出电负性的大小与元素非金属性的强弱关系是元素的电负性越大,其非金属性越强;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlCl3中的化学键类型应该是共价键.
(1)元素的性质特别是化学性质取决于元素原子结构.钠离子的电子式为Na+,铝元素的原子结构示意图为
 .
.(2)钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+(用离子符号表示).在短周期中非金属性最强的元素位于第二周期第VIIA族.
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律.下列有关说法正确的是b、d(选填编号).
a.元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性.第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
12.下列有关气体摩尔体积的描述中正确的是( )
| A. | 气体摩尔体积的数值是固定不变的,都约为22.4L | |
| B. | 通常情况的气体摩尔体积约为22.4L | |
| C. | 标准状况下的气体的摩尔体积约为22.4L | |
| D. | 标准状况下,气体的摩尔体积约为22.4L/mol |
10.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢.锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢.已知部分物质20℃时的溶解度数据为
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑,MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是C(填序号).
A、食醋 B、氯化钡 C、碳酸钠 D碳酸氢钠
CaSO4能转化为物质Y 的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)MgCO3和CaCO3.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是C(填序号).
A、食醋 B、氯化钡 C、碳酸钠 D碳酸氢钠
CaSO4能转化为物质Y 的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)MgCO3和CaCO3.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01mol/L.
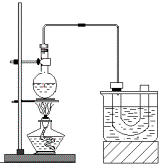 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)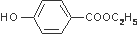 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):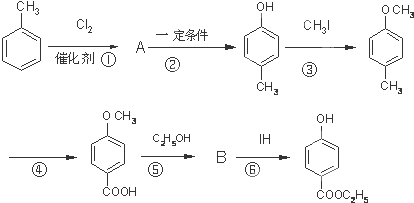
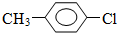 .
. +CH3I→
+CH3I→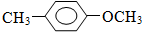 +HI
+HI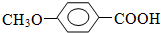 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$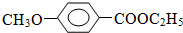 C2H5OH+H2O
C2H5OH+H2O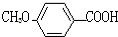 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式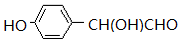 .
.