题目内容
Al溶于NaOH溶液中,4mol Al失去的电子全被水获得,作为氧化剂的H2O的物质的量为 .
考点:氧化还原反应的计算
专题:
分析:Al与氢氧化钠溶液反应本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝再与氢氧化钠反应生成偏铝酸钠与水,反应中水作氧化剂,根据2Al+6H2O=2Al(OH)3+3H2↑计算氧化剂水的物质的量.
解答:
解:Al与氢氧化钠溶液反应本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝再与氢氧化钠反应生成偏铝酸钠与水,反应中水作氧化剂,根据2Al+6H2O=2Al(OH)3+3H2↑,可知氧化剂水的物质的量为4mol×
=12mol,故答案为:12mol.
| 6 |
| 2 |
点评:本题考查氧化还原反应计算,难度中等,为易错题目,明确反应原理是关键,可以利用氢氧化铝中氢氧根计算氧化剂水的物质的量.

练习册系列答案
相关题目
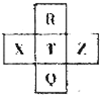 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
短周期的A、B、C、D、E物种元素,原子序数依次增大.已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素.下列叙述不正确的是( )
| A、原子半径:C>D>B |
| B、元素B的气体氢化物的沸点比元素E气体氢化物的沸点高 |
| C、元素A的氧化物的大量排放能引起温室效应 |
| D、元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是( )
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、28g氮气所含有的氮原子数目为NA |
| B、1mol铁与足量氯气反应转移电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、1mol?L-1 K2SO4溶液中含有的钾离子数目为2NA |
下列反应的离子方程式正确的是( )
| A、向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN-?Fe(SCN)3↓ |
| B、向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |