题目内容
下列离子方程式不正确的是( )
| A、硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O=4Al(OH)3↓ |
| B、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| C、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、小苏打溶液跟烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.硫酸铝溶液跟偏铝酸钠溶液反应,发生双水解生成强氧化铝;
B.碳酸钙为沉淀、醋酸为弱电解质,均应保留化学式;
C.次氯酸钙溶液中通入过量二氧化碳,反应生成碳酸氢钙;
D.小苏打溶液跟烧碱溶液反应,反应生成碳酸钠和水.
B.碳酸钙为沉淀、醋酸为弱电解质,均应保留化学式;
C.次氯酸钙溶液中通入过量二氧化碳,反应生成碳酸氢钙;
D.小苏打溶液跟烧碱溶液反应,反应生成碳酸钠和水.
解答:
解:A.硫酸铝溶液跟偏铝酸钠溶液反应,离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故A正确;
B.碳酸钙跟醋酸反应,离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故B正确;
C.次氯酸钙溶液中通入过量二氧化碳,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故C错误;
D.小苏打溶液跟烧碱溶液反应,离子方程式为:HCO3-+OH-=CO32-+H2O,故D正确;
故选:C.
B.碳酸钙跟醋酸反应,离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故B正确;
C.次氯酸钙溶液中通入过量二氧化碳,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故C错误;
D.小苏打溶液跟烧碱溶液反应,离子方程式为:HCO3-+OH-=CO32-+H2O,故D正确;
故选:C.
点评:本题考查了离子方程式的书写,把握化学反应的实质和离子方程式书写的方法是解题关键,注意化学式的拆分、反应物量的关系对反应的影响,题目不难.

练习册系列答案
相关题目
通式为CnH2n-2的一种气态烃完全燃烧后生成的CO2和H2O物质的量之比为4:3.这种烃的链状同分异构体有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
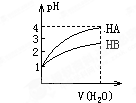 常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正确的是( )| A、在稀释过程中HA与HB溶液中c(OH-)均增大 |
| B、当稀释100倍时,HB的pH为3 |
| C、在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) |
| D、等物质的量浓度的HA和HB,其酸性HA<HB |
某溶液中含有NO
、SO
、AlO
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中的阴离子数目一定不改变是( )
- 3 |
2- 4 |
- 2 |
A、NO
| ||
B、SO
| ||
| C、S2- | ||
D、AlO
|
下列条件下,两瓶气体中所含的分子数相等的是( )
| A、同压强、同体积的N2O和CO2 |
| B、同温度、同体积的氮气和氯气 |
| C、同体积、同密度的乙烯和丙烯 |
| D、同温度、同压强、同体积的氦气和氢气 |
对于在一密闭容器中进行的下列反应:C(s)+O2(g)?CO2(g)下列说法中错误的是( )
| A、将木炭粉碎成粉末状可以加快化学反应速率 |
| B、升高温度可以加快化学反应速率 |
| C、把容器的体积缩小到原来的一半,各物质的物质的量不变,化学反应速率不变 |
| D、增加木炭的量可以加快化学反应速率 |
下列数量的物质中,含原子数最多的是( )
| A、标准状况下11.2LCO2 |
| B、0.2mol NH3 |
| C、4.5g水 |
| D、6.02×1023个Ar原子 |
下列做法符合食品安全要求的是( )
| A、在食盐中加适量乳酸锌以防止儿童缺锌 |
| B、用聚氯乙烯(PVC)材料作为食品保鲜膜 |
| C、制作膨化食品时可加入过量的膨松剂硫酸铝铵 |
| D、加工香肠时可加入过量的亚硝酸钠使其呈现亮红的颜色 |