��Ŀ����
��ͼ��ʾ����ʵ���ҽ��а��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������

��l��д��װ��A���������Ļ�ѧ��Ӧ ��
��2��װ��B��ʢ���Լ��� ��
��3����ȼC���ƾ��ƣ��رյ��ɼ�2�����ɼ�1���ӷ�Һ©���ų�Ũ��ˮ����û��ƿ�й����رշ�Һ©�����Ժ�Ƭ�̣�װ��C�к�ɫ������죬װ��E����Һ����ִ������ݣ�ͬʱ���� ����д��Ӧ������E���ݳ�Һ����������ֱ�������������д����C�з�����Ӧ�Ļ�ѧ����ʽ ��
��4����֪Cu2O��һ�ֺ�ɫ�������ʣ��ڸ��������¿���CuO�ֽ�õ���4CuO�T2Cu2O+O2�������ɵ�Cu2OҲ�ܱ�NH3��ԭ����C�й���ȫ�����ɫ�رյ��ɼ�1�������ƿ��ƾ��ƣ�����ȴ����C�й�������������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ͨ������ȷ���ù������ijɷ��� ���û�ѧʽ��ʾ����
��5���ڹرյ��ɼ�1���ɼ�2�������������F�У��ܿ췢��װ��F�в������̣�ͬʱ����G����ҺѸ�ٵ�������F�У�д���������̵Ļ�ѧ����ʽ ��

��l��д��װ��A���������Ļ�ѧ��Ӧ
��2��װ��B��ʢ���Լ���
��3����ȼC���ƾ��ƣ��رյ��ɼ�2�����ɼ�1���ӷ�Һ©���ų�Ũ��ˮ����û��ƿ�й����رշ�Һ©�����Ժ�Ƭ�̣�װ��C�к�ɫ������죬װ��E����Һ����ִ������ݣ�ͬʱ����
��4����֪Cu2O��һ�ֺ�ɫ�������ʣ��ڸ��������¿���CuO�ֽ�õ���4CuO�T2Cu2O+O2�������ɵ�Cu2OҲ�ܱ�NH3��ԭ����C�й���ȫ�����ɫ�رյ��ɼ�1�������ƿ��ƾ��ƣ�����ȴ����C�й�������������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ͨ������ȷ���ù������ijɷ���
��5���ڹرյ��ɼ�1���ɼ�2�������������F�У��ܿ췢��װ��F�в������̣�ͬʱ����G����ҺѸ�ٵ�������F�У�д���������̵Ļ�ѧ����ʽ
���㣺������ȡ������
ר�⣺ʵ����
��������l����ˮ���������ƣ������ƺ�ˮ��Ӧ���ȣ�ʹ��ˮ�ֽ����ɰ����������ƺ�ˮ��Ӧ���ɼ�ʹ��ˮƽ�����㷴Ӧ�����ƶ���
��2������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�ң�
��3����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ��
װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��
��4�����ɵĺ�ɫ���ʿ���ΪCu2O��Cu���������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g-2.4g=13.6g������ʣ�������Cu����Ԫ������ȷ����ɣ���������n��Cu����n��O��ȷ����ɣ�
��5��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl��
��2������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�ң�
��3����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ��
װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��
��4�����ɵĺ�ɫ���ʿ���ΪCu2O��Cu���������Ӧǰ��������Ϊ16g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g-2.4g=13.6g������ʣ�������Cu����Ԫ������ȷ����ɣ���������n��Cu����n��O��ȷ����ɣ�
��5��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl��
���
�⣺��1����ˮ�д��ڵ���ƽ��NH3��+H2O?NH3?H2O?NH4++OH-����ˮ���ȷֽ�NH3?H2O
NH3��+H2O�������ƺ�ˮ��ӦCaO+H2O=Ca��OH��2�������ƺ�ˮ��Ӧ���ɼ�ͬʱ�ų������ȣ��������ڰ����ݳ�������װ��A���������Ļ�ѧ��ӦΪ��NH3?H2O+CaO=Ca��OH��2+NH3����
�ʴ�Ϊ��NH3?H2O+CaO=Ca��OH��2+NH3����
��2������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�һ���ʯ�ң�
�ʴ�Ϊ����ʯ�һ���ʯ�ң�
��3����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ���ʻ��а�ɫ����������
װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��NH3+CuO
Cu+N2��+H2O��
�ʴ�Ϊ����ɫ������2NH3+3CuO
3Cu+N2��+3H2O��
��4��16gCuO�к���CuԪ������Ϊ16g��
=12.8g��������Ԫ������Ϊ16g-12.8g=3.2g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g-2.4g=13.6g������12.8g����ʣ����庬��Cu��OԪ�أ���n��Cu��=
=0.2mol������OԪ�ص�����Ϊ13.6g-12.8g=0.8g��n��O��=
=0.05mol��n��Cu����n��O��=0.2mol��0.05mol=4��1��2��1����ʣ�����ΪCu2O��Cu��
�ʴ�Ϊ��Cu2O��Cu
��5��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl����Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl���ʴ�Ϊ��3Cl2+8NH3=N2+6NH4Cl��
| ||
�ʴ�Ϊ��NH3?H2O+CaO=Ca��OH��2+NH3����
��2������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�һ���ʯ�ң�
�ʴ�Ϊ����ʯ�һ���ʯ�ң�
��3����Ӧ���β���к���δ��Ӧ�İ�����������E��Һ�����������Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ���ʻ��а�ɫ����������
װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��NH3+CuO
| ||
�ʴ�Ϊ����ɫ������2NH3+3CuO
| ||
��4��16gCuO�к���CuԪ������Ϊ16g��
| 64 |
| 80 |
| 12.8g |
| 64g/mol |
| 0.8g |
| 16g/mol |
�ʴ�Ϊ��Cu2O��Cu
��5��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl����Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl���ʴ�Ϊ��3Cl2+8NH3=N2+6NH4Cl��
���������⿼�鰱�����Ʊ�������ʵ�顢��װ�õ����⡢ʵ���������ѧ����ȣ��Ѷ��еȣ��������ʵ���������ԭ���ǽ���Ĺؼ����Ƕ�֪ʶ���ۺϿ��飬��Ҫѧ��������ʵ�Ļ�����������⡢��������������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
���ݵ���������Ӧ���Ȼ�ѧ����ʽ����i�� I2��g��+H2��g��?2HI��g����H1=-9.48kJ?mol-1
��ii�� I2��S��+H2��g��?2HI��g����H1=+26.48kJ?mol-1�������ж���ȷ���ǣ�������
��ii�� I2��S��+H2��g��?2HI��g����H1=+26.48kJ?mol-1�������ж���ȷ���ǣ�������
| A��127g I2��g����ͨ��1gH2��g������Ӧ�ų�������С��4.74kJ |
| B��1 mol��̬����1 mol��̬���������������17.00 kJ |
| C����Ӧ��ii���ķ�Ӧ���������ȷ�Ӧ��i���ķ�Ӧ���������� |
| D����Ӧ��i���IJ���ȷ�Ӧ��ii���IJ����ȶ� |
����ʵ��װ�á�ѡ�õ��Լ���ʵ������У�����ȷ���ǣ�������
A�� �ɷ�ֹ�������� |
B�� ϡ��Ũ���� |
C�� ���װ�������� |
D�� ��ȥCO2�е�HCl |
����ԭ�Ӳ�������ͬһƽ����ǣ�������
| A����ϩ | B���� | C����Ȳ | D������ |
���л������У����ܹ����ۻ�״̬�������ܹ���ˮ��Һ״̬������ǣ�������
| A�������� |
| B��NaHCO3 |
| C������ |
| D��NaOH |
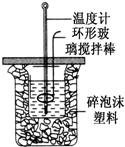 ��50mL 0.50mol?L-1������50mL 0.55mol?L-1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�
��50mL 0.50mol?L-1������50mL 0.55mol?L-1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�