题目内容
18.X常温下是一种无色液体,极易水解,遇潮湿空气会产生白雾.实验室制备X可用A、C两种气体发生化合反应制得,物质转化过程如图:
为探究X的组成,取13.5gX与足量水完全反应,在生成物中加入1.0mol/L的NaOH溶液40.0mL恰好显中性.继续加入过量BaCl2溶液,产生沉淀2.33g.
请回答:
(1)由Na2SO3和B反应生成C的离子方程式SO32-+2H+═SO2↑+H2O
(2)X的分子式是SO2Cl2或SCl2O2.在生成X的反应中,C表现了还原 性.
分析 由转化关系可知A为Cl2,加入过量BaCl2溶液,产生沉淀,说明X水解生成SO42-,则X中含有S、Cl元素,且S为+6价,应为SO2Cl2或SCl2O2,水解可生成硫酸和盐酸,1molSO2Cl2可水解生成1mol硫酸,2molHCl,13.5gX的物质的量为$\frac{13.5g}{135g/mol}$=0.1mol,可与0.4molNaOH中和,符合题意,则C为SO2,B为酸,以此解答该题.
解答 解:(1)由以上分析可知Na2SO3和B反应生成C为二氧化硫,B为酸,反应的离子方程式为SO32-+2H+═SO2↑+H2O,故答案为:SO32-+2H+═SO2↑+H2O;
(2)由以上分析可知X为SO2Cl2或SCl2O2,由二氧化硫被氯气氧化生成,C表现还原性,故答案为:SO2Cl2或SCl2O2; 还原.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握题给信息以及相关数据的处理,把握物质的性质,难度不大.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
9.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
若某反应的平衡常数表达式为:k=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•molˉ1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
①反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=1.975;2.00min~5.00min内,O2的平均反应速率为0.055mol•Lˉ1•minˉ1.
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化
b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5)
d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O 4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-1.将一定量的NO放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
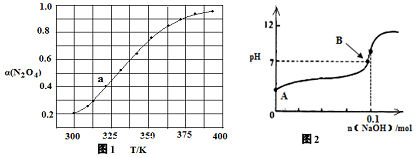
如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量0.099mol(保留两位有效数字).
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
若某反应的平衡常数表达式为:k=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•molˉ1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化
b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5)
d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O 4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-1.将一定量的NO放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量0.099mol(保留两位有效数字).
6.下列反应的离子方程式正确的是( )
| A. | 制作印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═2CaCO3↓+2H2O+CO32- | |
| D. | 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O═Ca2++2Cl-+CO2↑+2H2O |
13.下列说法中,不正确的是( )
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
3.下列关于有机化合物的叙述正确的是( )
| A. | 氟利昂-12的结构式为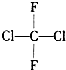 ,该分子是平面型分子 ,该分子是平面型分子 | |
| B. | 苯与液溴混合后撤入铁粉发生了加成反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
10.据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径.某实验小组对NO2和SO2的反应进行探究.
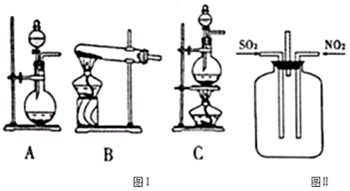
(1)SO2的发生装置可以选择图Ⅰ中的A(或C )(填字母),反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O[或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O].
(2)按图Ⅱ所示进行实验.
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为SO2+NO2=SO3+NO.如果集气瓶中有少量水,则可能观察不到白烟,其原因是生成的SO3与水反应生成硫酸.
②请指出图Ⅱ装置设计的不合理之处没有进行尾气处理,会导致环境污染.
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:

(1)SO2的发生装置可以选择图Ⅰ中的A(或C )(填字母),反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O[或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O].
(2)按图Ⅱ所示进行实验.
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为SO2+NO2=SO3+NO.如果集气瓶中有少量水,则可能观察不到白烟,其原因是生成的SO3与水反应生成硫酸.
②请指出图Ⅱ装置设计的不合理之处没有进行尾气处理,会导致环境污染.
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
7.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法错误的是( )
| A. | 原子半径:W>X>Y>Z>M | |
| B. | XZ2为直线形的共价化合物 | |
| C. | X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键 |