题目内容
13.在标准状况下,向体积为VL的容器中放入amol CS2 和bmol O2,待燃烧后恢复到开始时的温度和压强条件时,容器中气体的物质的量为( )| A. | amol | B. | bmol | C. | (3a-b)mol | D. | (a+b)mol |
分析 二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2;依据反应前后气体物质的量的变化计算判断.
解答 解:二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2;二硫化碳(CS2)是液体,反应前后气体物质的量为氧气的物质的量,所以反应后的气体物质的量为bmol;
故选B.
点评 本题考查了化学方程式的计算,主要考查了反应前后的气体体积变化特征,不需计算根据反应特征直接判断,较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.抗酸药M可能的组成可以表示为MgaAlb(OH)c(CO3)d(a、b、c、d都不小于0).已知Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,pH=11.4时沉淀完全.实验如下:
(1)本实验需要称量固体,应选择的称量仪器是电子天平(填“托盘天平”或“电子天平”)
(2)M中a、b、c、d之间定量关系式为2a+3b=c+2d.
(3)根据上述数据,确认M的化学式为Mg3Al2(OH)10CO3.
(4)步骤①中反应的离子方程式为10OH-+CO32-+12H+=CO2↑+11H2O.
(5)ω=$\frac{365}{w}$%.
| 步骤 | 实验操作 | 实验现象及数据 |
| ① | 取wgM粉末溶于过量的盐酸 | 产生气体X在标准状况下的体积为224mL,并得到无色溶液 |
| ② | 向步骤①所得的溶液中滴加氨水,调节pH至6,过滤、洗涤、灼烧、称重 | 固体Y的质量为1.020g |
| ③ | 向步骤②所得的滤液中滴加氢氧化钠溶液,调节pH至12,过滤、洗涤、灼烧、称重 | 固体Z的质量为1.200g |
(2)M中a、b、c、d之间定量关系式为2a+3b=c+2d.
(3)根据上述数据,确认M的化学式为Mg3Al2(OH)10CO3.
(4)步骤①中反应的离子方程式为10OH-+CO32-+12H+=CO2↑+11H2O.
(5)ω=$\frac{365}{w}$%.
4.用高铁酸钠对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2 $\frac{\underline{\;熔融\;}}{\;}$2Na2FeO4+Na2O,下列说法正确的是( )
| A. | 过氧化钠既是氧化剂又是还原剂 | |
| B. | 3摩尔过氧化钠发生反应,有12摩尔电子转移 | |
| C. | 在高铁酸钠中铁为+4价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钠既是氧化产物又是还原产物 |
1.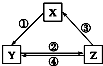 不能实现如图所示的变化的是( )
不能实现如图所示的变化的是( )
 不能实现如图所示的变化的是( )
不能实现如图所示的变化的是( ) | 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
| A. | A | B. | B | C. | C | D. | D |
18.在反应 2X+5Y═4R+2M中,已知R 和M 的摩尔质量之比为22:9,当2.6克X与Y 完全反应,生成4.4克R,则在此反应中Y 和M 的质量比为( )
| A. | 26:9 | B. | 39:9 | C. | 40:9 | D. | 53:9 |
5.下图是元素周期表的一部分,表中的①~⑩中元素,用 元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为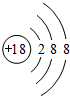
(2)用电子式表示②与④形成化合物的过程 .
.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)用电子式表示②与④形成化合物的过程
 .
.(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
2.关于乙烯分子中有5个σ键、一个π键,下列说法正确的是( )
| A. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| B. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| C. | C、H之间形成的是s-p σ键,C、C之间的π键是未参加杂化的2p轨道形成的 | |
| D. | C、C之间形成的是sp2-sp2σ键,C、H之间是未参加杂化的2p轨道形成的π键 |
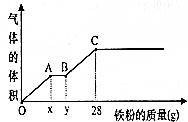 将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):
将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):