题目内容
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g)
CO+H2.C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②H2(g)+
O2(g)=H2O(g)△H2=-242.0kJ?mol-1;
③CO(g)+
O2(g)=CO2(g)△H3=-283.0kJ?mol-1;
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式: .
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量 (填“多”或“少”).
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图

请你写出△H1、△H2、△H3、△H4之间存在的关系式 .
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是 (填“甲”或“乙”)同学,另一同学出现错误观点的原因是 .
| ||
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图

请你写出△H1、△H2、△H3、△H4之间存在的关系式
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是
考点:热化学方程式,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)先根据燃烧热写出热化学方程式,然后根据盖斯定律来解答;
(2)依据热化学方程式分析判断反应放出的热量;
根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
根据煤转化为水煤气要吸收热量分析.
(2)依据热化学方程式分析判断反应放出的热量;
根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
根据煤转化为水煤气要吸收热量分析.
解答:
解:(1)①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②CO(g)+
O2(g)=CO2(g)△H=-283.0 kJ/mol,
③H2(g)+
O2(g)=H2O(g)△H=-242.0kJ/mol,
④H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol;
(2)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②H2(g)+
O2(g)=H2O(g)△H2=-242.0kJ?mol-1;
③CO(g)+
O2(g)=CO2(g)△H3=-283.0kJ?mol-1;
比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多,
化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;
依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;
煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;
故答案为:多;△H1=△H2+△H3+△H4;乙;甲同学忽略了煤转化为水煤气要吸收热量.
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
④H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol;
(2)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多,
化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;
依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;
煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;
故答案为:多;△H1=△H2+△H3+△H4;乙;甲同学忽略了煤转化为水煤气要吸收热量.
点评:本题主要考查了热化学方程式书写和计算,盖斯定律的应用分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
硫酸的浓度为0.005mol/L,则溶液的PH值为( )
| A、2 | B、4 | C、10 | D、12 |
下列离子在指定溶液中一定能大量共存的是( )
| A、含有NaClO的溶液中:Fe2+、NO3-、K+、Cl- | ||
| B、无色溶液中:AlO2-、HCO3-、K+、Na+ | ||
C、
| ||
| D、能使pH试纸变红色的溶液中:Fe2+、SO42-、Cu2+、Cl- |
可逆反应2SO2+O2?2SO3 在密闭容器中进行,下列有关说法中错误的是( )
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
某校科研小组的同学设计了如图实验装置,下列判断中正确的是( )


| A、烧杯a中的溶液pH升高 |
| B、铁片作负极 |
| C、烧杯a中发生反应为2H++2e-═H2↑ |
| D、烧杯b中有氯气产生 |
下列关于常见有机物的说法正确的是( )
| A、乙烯和苯都能与溴水反应 |
| B、甲烷与足量的氯气取代反应最终生成物只有一种四氯化碳 |
| C、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
| D、石油分馏和煤的干馏都能是化学反应 |
下列有关化学用语表示正确的是( )
| A、HClO的结构式:H-Cl-O |
B、Cl-的结构示意图: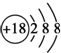 |
C、Na2O2的电子式: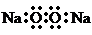 |
| D、Na原子外围电子排布式:3s1 |