题目内容
二氧化锰是常见的催化剂,碳酸锰热分解法是目前制备二氧化锰的主要方法,其反应原理为:
①2MnCO3+O2═2MnO2+2CO2.经研究发现该反应过程为:②MnCO3═MnO+CO2,③2MnO+O2═2MnO2.
(1)试写出反应①的平衡常数表达式K1= ,K1与反应②、③的平衡常数K2、K3关系为 .
(2)反应③在低温下能自发进行,则其△H 0(填“>”、“<”、“=”).
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究.获得三幅图(如图所示).则制备焙烧温度为 ,气氛条件为 .
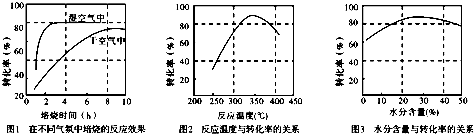
(4)图2中是在常压下获得的数据,试在图2中用虚线画出10MPa下反应温度与转化率的关系图.
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为 ,电解后溶液的pH将 (填“增大”、“减小“或不变“).
①2MnCO3+O2═2MnO2+2CO2.经研究发现该反应过程为:②MnCO3═MnO+CO2,③2MnO+O2═2MnO2.
(1)试写出反应①的平衡常数表达式K1=
(2)反应③在低温下能自发进行,则其△H
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究.获得三幅图(如图所示).则制备焙烧温度为

(4)图2中是在常压下获得的数据,试在图2中用虚线画出10MPa下反应温度与转化率的关系图.
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为
考点:化学平衡常数的含义,反应热和焓变,化学电源新型电池,化学平衡建立的过程
专题:基本概念与基本理论
分析:(1)生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;①为方程②③之和,所以K1=K2×K3;
(2)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
(3)由图分析在在指定温度下和水分含量下碳酸锰转化率要高;
(4)对反应2MnCO3+O2═2MnO2+2CO2正反应是气体体积缩小的反应,所以增大压强平衡逆向转化率变小;
(5)阳极发生氧化反应,锰由+2价变成+4价,产生大量的氢离子.
(2)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
(3)由图分析在在指定温度下和水分含量下碳酸锰转化率要高;
(4)对反应2MnCO3+O2═2MnO2+2CO2正反应是气体体积缩小的反应,所以增大压强平衡逆向转化率变小;
(5)阳极发生氧化反应,锰由+2价变成+4价,产生大量的氢离子.
解答:
解:(1)反应①的平衡常数表达式K1=
,K1与反应②、③的平衡常数K2、K3关系为:①为方程②的系扩大2倍后与③之和所以K1=K22×K3,故答案为:
;K1=K22×K3;
(2)反应③在低温下能,只有△H<0,△G<0反应自发,故答案为:<;
(3)由图2分析,在350℃左右碳酸锰转化率比较高,由图3可知水分含量的30%左右碳酸锰转化率比较高(或20%-40%都正确),故答案为:350℃(或325-375℃都正确);30%(或20%-40%都正确);
(4)对反应2MnCO3+O2═2MnO2+2CO2正反应是气体体积缩小的反应,所以增大压强平衡逆向转化率变小,所以图为(在原实线下即可)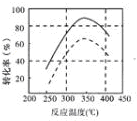 ,故答案为:
,故答案为: ;
;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,产生大量的氢离子,电解后溶液的pH将减小,故答案为:Mn2++2H2O-2e-=MnO2+4H+; 减小.
| C2(CO2) |
| C(O2) |
| C2(CO2) |
| C(O2) |
(2)反应③在低温下能,只有△H<0,△G<0反应自发,故答案为:<;
(3)由图2分析,在350℃左右碳酸锰转化率比较高,由图3可知水分含量的30%左右碳酸锰转化率比较高(或20%-40%都正确),故答案为:350℃(或325-375℃都正确);30%(或20%-40%都正确);
(4)对反应2MnCO3+O2═2MnO2+2CO2正反应是气体体积缩小的反应,所以增大压强平衡逆向转化率变小,所以图为(在原实线下即可)
 ,故答案为:
,故答案为: ;
;(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,产生大量的氢离子,电解后溶液的pH将减小,故答案为:Mn2++2H2O-2e-=MnO2+4H+; 减小.
点评:本题考查化学平衡常数的含义,平衡移动、电化学相关知识,综合性强,学生要有一定的化学基本功才能解决.

练习册系列答案
相关题目
下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的有( )
| A、乙酸乙酯 | B、乙醛 |
| C、对二甲苯 | D、甲苯 |
下列反应属于加成反应的是( )
| A、乙烯与氧气的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色的反应 |
| C、甲烷与氯气在光照下的反应 |
| D、乙烯在催化剂作用下与水反应 |
某化学反应反应物的总能量大于生成物的总能量,则该反应( )
| A、是吸热反应 |
| B、是放热反应 |
| C、不一定遵循质量守恒定律 |
| D、不需要加热就一定能发生 |
符合化学式C7H8O的芳香族化合物,同分异构体共有X种,能与金属钠反应放出氢气的有Y种,能与氢氧化钠反应的有Z种,则X.Y.Z的数值分别是( )
| A、5.4.3 |
| B、4.4.3 |
| C、4.3.2 |
| D、3.3.3 |
 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.