题目内容
SO2是形成酸雨的罪魁祸首.
SO2的摩尔质量为 ,64g SO2的物质的量为 ,在标准状况下的体积约为 ,所含原子数为 .
SO2的摩尔质量为
考点:物质的量的相关计算
专题:
分析:摩尔质量数值上等于相对分子质量,摩尔质量的单位为g/mol,根据n=
计算SO2的物质的量,根据V=n×Vm计算SO2在标准状况下的体积,根据SO2的分子式计算所含原子数.
| m |
| M |
解答:
解:SO2的相对分子质量为32+16×2=64,摩尔质量数值上等于相对分子质量,摩尔质量的单位为g/mol,即SO2的摩尔质量为64g/mol;64g SO2的物质的量为n=
=
=1mol,SO2在标准状况下的体积V=n×Vm=1mol×22.4L/mol=22.4L,1molSO2含有3mol原子,N=n×NA=3NA=1.806×1024,
故答案为:64g/mol;1mol;22.4L;3NA或1.806×1024.
| m |
| M |
| 64g |
| 64g/mol |
故答案为:64g/mol;1mol;22.4L;3NA或1.806×1024.
点评:本题考查物质的量的计算,题目难度不大,注意相关公式的熟练应用,注意摩尔质量的单位.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列说法中,正确的是( )
| A、NH3的水溶液能导电,所以NH3是电解质 |
| B、K2SO4既是钾盐又是硫酸盐 |
| C、向醋酸溶液中加入少量氢氧化钠固体,由于有水生成溶液的导电能力降低 |
| D、稀盐酸能导电所以稀盐酸是电解质 |
下列关于N2和CO的判断错误的是( )
| A、电子数相等时具有相等的质量 |
| B、同温同压下质子数相等则体积相等 |
| C、体积相等时质量一定相等 |
| D、质量相等时具有相等的分子数 |
和22g CO2所含分子数相等的水的质量为( )
| A、44 g |
| B、22 g |
| C、18 g |
| D、9 g |
设N0为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、12g石墨烯(单层石墨)中含有六元环的个数为0.5N0 |
| B、1.0L1.0mo1?L-1的NaNO3水溶液中含有的氧原子数为3N0 |
| C、25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 |
| D、1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
能正确表示下列化学反应的离子方程式是( )
| A、氢氧化钡溶液与稀硫酸的反应OH-+H+=H2O |
| B、氧化镁与稀盐酸反应MgO+2H+=Mg2++H2O |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、少量碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2CO3 |
 请回答:
请回答: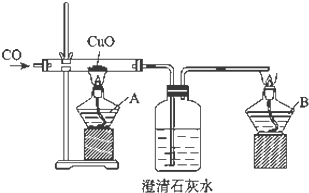 证明CO具有还原性的实验装置,如图所示.
证明CO具有还原性的实验装置,如图所示.