题目内容
1.难溶电解质在水中存在溶解平衡,如AgCl(s)?Ag+(aq)+Cl-(aq),一定温度下,在AgCl悬浊液中,c(Ag+)和c(Cl-)的乘积Ksp为一常数.已知Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10.(1)若把足量AgCl分别放入100mL的下列物质中,充分搅拌后,在相同温度下,c(Ag+)最大的是A.
A.蒸馏水 B.0.2mol/LNaCl溶液 C.0.10mol/LAlCl3溶液 D.0.12mol/LMgCl2溶液
(2)在0.10mol/LAlCl3溶液中,c(Ag+)最大值是6×10-10mol/L.
分析 依据在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP=c(Ag+)•c(Cl-)=1.8×10-10,温度不变,Ksp不变,c(Cl-)越小,则c(Ag+)越大,结合Ksp计算银离子浓度,
解答 解:(1)KSP=c(Ag+)•c(Cl-)=1.8×10-10,c(Cl-)越小,则c(Ag+)越大,由题给数据可知题中c(Cl-)由小到大的顺序为A<B<D<C,则c(Ag+)最大的是A,
故答案为:A;
(2)在0.10mol/LAlCl3溶液中,c(Cl-)=0.3mol/L,则c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.3}$mol/L=6×10-10mol/L,
故答案为:6×10-10mol/L.
点评 本题考查了难溶物质的沉淀溶解平衡的应用,溶度积的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等.

练习册系列答案
相关题目
18.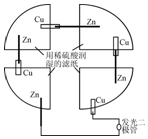 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
15.核内中子数为N的R2+,质量数为A,则ngR2+所含电子的物质的量是( )
| A. | $\frac{n(A-N-2)}{A}$ mol | B. | $\frac{n(A-N+8)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N+2)}{A}$mol |
6.已知20°C时AgBr的溶解度为8.4×10-6AgCI的溶解度为1.5×10-4将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银,发生的反应为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl沉淀多于AgBr沉淀 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl和AgBr沉淀等量生成 |
13.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
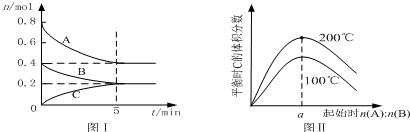

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
10.(1)反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.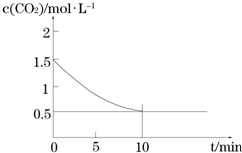
①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.

①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
11.下列反应的离子方程式错误的是( )
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O═Al (OH)3↓+3NH4+ | |
| C. | 硫氢化钠水解:HS-+H2O?H2S+OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
 如图都是简化的碳架结构:
如图都是简化的碳架结构: