题目内容
6.已知20°C时AgBr的溶解度为8.4×10-6AgCI的溶解度为1.5×10-4将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银,发生的反应为( )| A. | 只有AgBr沉淀生成 | B. | AgCl沉淀多于AgBr沉淀 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl和AgBr沉淀等量生成 |
分析 向AgCl与 AgBr的饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但AgBr的溶解度更小,溶液中AgCl沉淀较多.
解答 解:在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,解答本题时注意AgCl的溶解度比AgBr大,加入硝酸银,抑制溶解平衡向右移动,生成沉淀更多,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列化学变化中,物质发生还原反应的是( )
| A. | C→CO2 | B. | CO2→CO | C. | FeCl2→FeCl3 | D. | H2SO4→BaSO4 |
3.“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸.其中正确的是( )
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
20.为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
| 实验目的 | 实验方法 |
| 证明地瓜粉中有淀粉 | B |
| 检验酒精中是否含有水 | C |
| 证明NaOH溶液呈碱性 | D |
| 除去FeCl2溶液中少量的FeCl3 | A |
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
11. 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
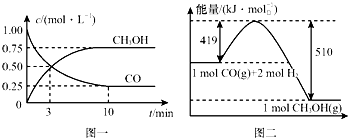
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是ADE.
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
15.工业制硝酸时,NH3在500℃时可发生如下3 个反应:
下列说法正确的是( )
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)═4 NO(g) K=400 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
16.下列有关反应热的说法正确的是( )
| A. | 吸热反应一定需要加热,放热反应一定不需要加热 | |
| B. | 甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | 常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | S (s)+O2(g)=SO2(g)△H1=-Q1 kJ/mol S (g)+O2(g)=SO2(g)△H2=-Q2 kJ/mol,则Q1<Q2 |