��Ŀ����
20����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����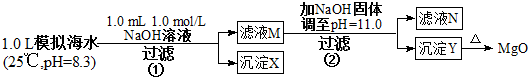
| ��ˮ�е�����Ũ�ȣ�mol/L�� | Na+ | Mg2+ | Ca2+ | Cl- | HCO3 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
ʵ������У�������Һ������䣮
��֪��Ksp��CaCO3��=4.96��10-9��Ksp��MgCO3��=6.82��10-6��
Ksp[Ca��OH��2]=4.68��10-6��Ksp[Mg��OH��2]=5.61��10-12��
����˵����ȷ���ǣ�������
| A�� | ������XΪCaCO3��MgCO3 | |
| B�� | ��ҺM�д���Mg2+��������Ca2+ | |
| C�� | ��ҺN�д���Mg2+��Ca2+ | |
| D�� | �����������Ϊ����8 g NaOH���壬������YΪCa��OH��2��Mg��OH��2�Ļ���� |
���� ����٣�����0.001mol NaOHʱ��OH- ǡ����HCO3-��ȫ��Ӧ������0.001molCO32-������Ksp��CaCO3������Ksp��MgCO3�������ɵ�CO32-��ˮ�е�Ca2+��Ӧ����CaCO3 ��������ҺM��ͬʱ������Ca2+��Mg2+��
����ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol•L-1��
�����ܶȻ����ж�Ca��OH��2 �Ƿ����ɳ�����һ����Mg��OH��2�������ɣ�
��� �⣺A������٣����������������֪n��NaOH ��=0.001mol��[��n��OH-��=0.001mol]���������ӷ�Ӧ�����к͡�����������������ķ�Ӧ���ɣ���1Lģ�⺣ˮ�У�����0.001mol NaOHʱ��OH- ǡ����HCO3-��ȫ��Ӧ��OH-+HCO3-=CO32-+H2O������0.001molCO32-������Ksp��CaCO3������Ksp��MgCO3�������ɵ�CO32-��ˮ�е�Ca2+��Ӧ����CaCO3 ����Ca2++CO32-=CaCO3�������Գ�����XΪCaCO3����A����
B������CO32-ֻ��0.001mol����Ӧ����CaCO3 �����ĵ�Ca2+Ҳֻ��0.001mol����Һ�л�ʣ��c��Ca2+��=0.010 mol•L-1����ҺM��ͬʱ������Ca2+��Mg2+����B����
C������ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol•L-1����
Q[Ca��OH��2]=c��Ca2+������10-3��2=0.010����10-3��2=10-8��Ksp[Ca��OH��2]����Ca��OH��2���ɣ�
Q[Mg��OH��2]=c��Mg2+������10-3��2=0.050����10-3��2=5��10-8��Ksp[Mg��OH��2]����Mg��OH��2�������ɣ�
������Ksp[Mg��OH��2]=c��Mg2+������10-3��2=5.6��10-12��c��Mg2+��=5.6��10-6��10-5����ʣ�࣬��ҺN�в�����Mg2+����C����
D�������������Ϊ����8 g NaOH���壬��n��NaOH��=$\frac{8g}{40g/mol}$=0.2mol����0.05mol Mg2+��Ӧ��Mg2++2OH-=Mg��OH��2��������0.05 mol Mg��OH��2��ʣ��0.1 mol OH-��
����Q[Ca��OH��2]=c��Ca2+������OH-��2=0.011����0.1��2=1.1��10-4��Ksp[Ca��OH��2]��������Ca��OH��2����������������YΪCa��OH��2��Mg��OH��2�Ļ�����D��ȷ��
��ѡD��
���� ������һ����ӱ�ļ����ͷ����ƶ��⣬������ͨ������ѡ���Դ�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽��Ϊ��������Ͽ����й��ܶȻ��ĸ�����㣬��һ�������龰��̲ĵ�֪ʶ�����л����������Ҫ���������ط��������ķ�Ӧ����Һ�д��ڵ����ӣ��ƶϳ����Ƿ�������Ӷ��ó���ȷ�Ľ��ۣ�����ǿ����ʵ�����Լ���ʶ�����������ۺ��ԣ��������¿γ̵���ɫ����Ŀ�Ѷ��еȣ�

 ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�| ������ | Ksp |
| Ca3��AsO4��2 | 6.8��10-19 |
| AlAsO4 | 1.6��10-16 |
| FeAsO4 | 5.7��10-21 |
| A�� | 5.7��10-18 mol•L-1 | B�� | 2.6��10-5mol•L-1 | ||
| C�� | 1.6��10-13mol•L-1 | D�� | 5.7��10-24mol•L-1 |
| A�� | ��NH4HCO3��Һ�м���������Ba��OH��2��Һ�����ȣ�Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+2H2O+BaCO3�� | |
| B�� | ����Ȼ�þ��Һ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH- | |
| C�� | ����CO2ͨ�뱽������Һ��2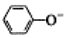 +CO2+H2O��2 +CO2+H2O��2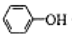 +CO32- +CO32- | |
| D�� | ��������Һ�еμ�Ba��OH��2��Һ����Һ�����ԣ�2Al3++3SO42-+3Ba2++6OH-�T3BaSO4��+2Al��OH��3�� |


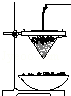 ��ɰ����Ҫ�ɷ�����״�Ĵ�����������ʯӢ��ʯ��ʯ�Ȼ���ij��ѧ��ȤС�����ɰ�з�������������������������ȷ�Ӧʵ�飮
��ɰ����Ҫ�ɷ�����״�Ĵ�����������ʯӢ��ʯ��ʯ�Ȼ���ij��ѧ��ȤС�����ɰ�з�������������������������ȷ�Ӧʵ�飮