题目内容
我国柴达木盆地拥有丰富的盐矿资源,其中的液体矿床以钾矿为主,伴生着镁、溴等多种成分.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有 ;固体A名称是 .检验操作①得到的无色溶液中Cl-的方案是: .
(2)工业上以浓缩海水为原料提取溴的部分过程如下:
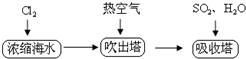
该研究小组在参观了溴的生产流程后,准备以盐湖苦卤为原料设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
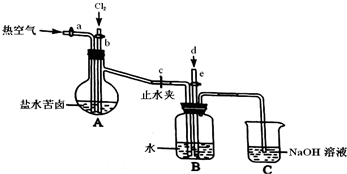
①检验装置A气密性的方法是 .
②该装置中的橡胶制品均要用特定的材料保护,其原因是 .
(3)某同学提出一种新的方案,对上述操作①后无色溶液进行除杂提纯,其方案流程如下:

有关资料:
(1)试剂B的化学式为 .
(2)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是 .
(3)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥ .(若离子浓度小于10-5mol?L-1可视作已被完全除尽)

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有
(2)工业上以浓缩海水为原料提取溴的部分过程如下:

该研究小组在参观了溴的生产流程后,准备以盐湖苦卤为原料设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

①检验装置A气密性的方法是
②该装置中的橡胶制品均要用特定的材料保护,其原因是
(3)某同学提出一种新的方案,对上述操作①后无色溶液进行除杂提纯,其方案流程如下:

有关资料:
| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
(2)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是
(3)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质,制备实验方案的设计
专题:实验设计题
分析:(1)最开始加的氧化剂将Br-氧化生成Br2,由加入CCl4可知,是用萃取剂萃取Br2,所以操作①是萃取,用到的玻璃仪器是分液漏斗、烧杯;
由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁;
硫酸银是微溶,影响氯离子的检验,因此先加过量的硝酸钡除掉SO42-,检验氯离子用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
(2)①装置气密性的检验可采用微热法,可用热空气代替加热;
②溴单质具有较强的腐蚀性,可加速该装置中的橡胶制品的老化;
(3)①无色溶液中含有K+、Mg2+、SO42-、Cl-,可加入KOH溶液和BaCl2溶液分别生成Mg(OH)2沉淀和BaSO4沉淀,加入K2CO3可以将大量的钡离子除去;
②用石灰乳代替试剂A进行实验,不能使硫酸根离子沉淀完全;
③确保Mg2+完全除尽,其浓度最大为10-5mol?L-1,结合Ksp计算.
由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁;
硫酸银是微溶,影响氯离子的检验,因此先加过量的硝酸钡除掉SO42-,检验氯离子用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
(2)①装置气密性的检验可采用微热法,可用热空气代替加热;
②溴单质具有较强的腐蚀性,可加速该装置中的橡胶制品的老化;
(3)①无色溶液中含有K+、Mg2+、SO42-、Cl-,可加入KOH溶液和BaCl2溶液分别生成Mg(OH)2沉淀和BaSO4沉淀,加入K2CO3可以将大量的钡离子除去;
②用石灰乳代替试剂A进行实验,不能使硫酸根离子沉淀完全;
③确保Mg2+完全除尽,其浓度最大为10-5mol?L-1,结合Ksp计算.
解答:
解:(1)最开始加的氧化剂将Br-氧化生成Br2,由加入CCl4可知,是用萃取剂萃取Br2,所以操作①是萃取,用到的玻璃仪器是分液漏斗、烧杯;
由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁;
硫酸银是微溶,影响氯离子的检验,因此先加过量的硝酸钡除掉SO42-,静置,在上层清液中加入用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
故答案为:分液漏斗、烧杯;硫酸镁;取少量无色溶液,加入过量硝酸钡溶液,静置,在上层清液中加入用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
(2)①装置气密性的检验可采用微热法,可用热空气代替加热,往蒸馏烧瓶中加入适量的水,塞紧塞子,再打开导管a上的活塞,关闭导管b上的活塞和止水夹c,往导管a通入空气,再关闭导管a上的活塞,若导管b中能上升一段稳定的水柱,则表明装置A气密性良好,
故答案为:往蒸馏烧瓶中加入适量的水,塞紧塞子,再打开导管a上的活塞,关闭导管b上的活塞和止水夹c,往导管a通入空气,再关闭导管a上的活塞,若导管b中能上升一段稳定的水柱,则表明装置A气密性良好;
②溴单质具有较强的腐蚀性,可加速该装置中的橡胶制品的老化,故答案为:橡胶易被溴腐蚀;
(3)①向盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)中加入氧化剂和四氯化碳以后,振荡溶液分层,下层是溶有溴的四氯化碳,此时所得的滤液主要含有大量的Mg2+、硫酸根离子,可加入KOH溶液和BaCl2溶液分别生成Mg(OH)2沉淀和BaSO4沉淀,加入K2CO3可以将大量的钡离子除去,
故答案为:K2CO3;
②用石灰乳代替试剂A进行实验,CaSO4的Ksp比BaSO4大得多,使用石灰乳难以使溶液中的SO42-沉淀完全,
故答案为:CaSO4的Ksp比BaSO4大得多,使用石灰乳难以使溶液中的SO42-沉淀完全;
确保Mg2+完全除尽,其浓度最大为10-5mol?L-1,则c(OH-)=
>0.001mol/L,所以广泛pH≥12,故答案为:12.
由实验目的制取较纯净的氯化钾晶体可知,要除掉无色溶液中的Mg2+、SO42-,因此固体A为硫酸镁;
硫酸银是微溶,影响氯离子的检验,因此先加过量的硝酸钡除掉SO42-,静置,在上层清液中加入用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
故答案为:分液漏斗、烧杯;硫酸镁;取少量无色溶液,加入过量硝酸钡溶液,静置,在上层清液中加入用HNO3酸化的硝酸银溶液,若产生白色沉淀,说明有Cl-;
(2)①装置气密性的检验可采用微热法,可用热空气代替加热,往蒸馏烧瓶中加入适量的水,塞紧塞子,再打开导管a上的活塞,关闭导管b上的活塞和止水夹c,往导管a通入空气,再关闭导管a上的活塞,若导管b中能上升一段稳定的水柱,则表明装置A气密性良好,
故答案为:往蒸馏烧瓶中加入适量的水,塞紧塞子,再打开导管a上的活塞,关闭导管b上的活塞和止水夹c,往导管a通入空气,再关闭导管a上的活塞,若导管b中能上升一段稳定的水柱,则表明装置A气密性良好;
②溴单质具有较强的腐蚀性,可加速该装置中的橡胶制品的老化,故答案为:橡胶易被溴腐蚀;
(3)①向盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)中加入氧化剂和四氯化碳以后,振荡溶液分层,下层是溶有溴的四氯化碳,此时所得的滤液主要含有大量的Mg2+、硫酸根离子,可加入KOH溶液和BaCl2溶液分别生成Mg(OH)2沉淀和BaSO4沉淀,加入K2CO3可以将大量的钡离子除去,
故答案为:K2CO3;
②用石灰乳代替试剂A进行实验,CaSO4的Ksp比BaSO4大得多,使用石灰乳难以使溶液中的SO42-沉淀完全,
故答案为:CaSO4的Ksp比BaSO4大得多,使用石灰乳难以使溶液中的SO42-沉淀完全;
确保Mg2+完全除尽,其浓度最大为10-5mol?L-1,则c(OH-)=
|
点评:本题以海水中提取氯化镁、溴为背景,考查了物质的分离、提纯的实验方法和基本操作,同时结合简单的实验流程图和溶解度图象,考查了学生基础知识和利用信息解决实际问题的综合应用能力.物质的分离与提纯的实验方法在实验题和化工题中都经常出现,是重要的实验基础知识.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
一定温度下2SO2+O2?2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=3:2:4.缩小体积,反应再次达到平衡时,n(O2)=0.4mol,n (SO3)=1.6mol,此时SO2的物质的量应是( )
| A、0.5mol |
| B、0.6moL |
| C、0.7mol |
| D、1.2mol |
向100ml 0.4mol/L的AlCl3溶液中逐滴加入0.2mol/L的NaOH溶液,若生成1.56克氢氧化铝沉淀,则加入氢氧化钠溶液的体积为( )
| A、200 ml |
| B、400 ml |
| C、450 ml |
| D、700ml |
下列叙述正确的是( )
| A、电化学反应不一定是氧化还原反应 |
| B、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| C、根据某反应的△H<0,判断该反应在此条件下一定能自发进行 |
| D、已知BaSO4和BaCO3的Ksp相近.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |

 某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
