题目内容
6.向Na2SO4和Al2(SO4)3的混合溶液中,逐滴加入KOH溶液.下列图象能正确表示反应生成沉淀的质量(m)与加入KOH溶液体积(v)的关系是( )| A. |  | B. |  | C. |  | D. |  |
分析 先发生Al3++3OH-=Al(OH)3↓,后发生Al(OH)3+OH-=AlO2-+2H2O,前后消耗氢氧化钾的物质的量之比为3:1,由此分析解答.
解答 解:先发生Al3++3OH-=Al(OH)3↓,后发生Al(OH)3+OH-=AlO2-+2H2O,前后消耗氢氧化钾的物质的量之比为3:1,所以生成沉淀的质量(m)与加入KOH溶液体积(v)的关系是 ,故选B.
,故选B.
点评 本题考查了化学反应与图形的关系,明确过程中发生的反应及图象表示的意义是解题关键,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
10.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 含大量OH-的溶液中:HCO3-、Na+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 0.1mol/L NaAlO2溶液:H+、Na+、Cl-、SO42- |
14.硫酸亚铁煅烧反应为2FeSO4(s)$\frac{\underline{\;高温\;}}{\;}$SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是( )
| A. | 该反应中FeSO4既作氧化剂,又作还原剂 | |
| B. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为1×6.02×1023 | |
| D. | 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀 |
11.在一密闭容器中存在如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析错误的是( )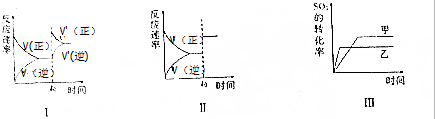

| A. | 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙的压强比甲高 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度比甲高 |
18.25℃时,下列溶液中微粒存在情况合理的是( )
| A. | 能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、I- | |
| B. | 含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 | |
| C. | 含K+、Na+、NO3-、CH3COO-的溶液中c(H+)=$\sqrt{{K}_{W}}$ | |
| D. | 在水电离出的c(H+)=10-13mol•L-1 的溶液中:NH4+、AlO2-、SO42-、NO3- |
15.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3. H2S CO2 | B. | H2O NH3•H2O HClO HF | ||
| C. | H2SO3. Ba(OH)2 BaSO4 | D. | H2SO3. Ba(OH)2 BaSO4 |
16.下列有关工业生产的说法错误的是( )
| A. | 高炉炼铁、生产普通硅酸盐水泥和普通玻璃都要用到的原料是石灰石 | |
| B. | 用电解饱和食盐水的方法制备金属钠 | |
| C. | 通常用海水提取食盐后的母液为原料制取溴单质 | |
| D. | 利用焦炭在高温下还原二氧化硅可制备粗硅 |