题目内容
10.A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:(1)写出F在周期表中的位置第三周期ⅥA族.画出D的离子结构示意图
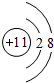 .
.(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
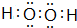 .
.(3)C与F形成的常见化合物属于分子晶体.若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T,R、S、T三者的沸点从高到低排列为SiO2>Na2O>NH3(写化学式)
(4)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol•L-1,则平衡时FC2的转化率为90%.
分析 A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;A与D为同一主族,且D的原子序数大于氧元素,D是所在周期原子半径最大的元素,故D为Na元素;六种元素所形成的常见单质在常温压下有三种是气体,三种是固体,故B、E的单质一种为气体、一种为固体,E的原子序数大于钠元素小于硫元素,故E为固体、B为气体,B的原子序数小于氧元素,则B为氮元素;由(3)可知,E是非金属元素,其单质在电子工业中有重要应用,则E为Si元素,据此解答.
解答 解:A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;A与D为同一主族,且D的原子序数大于氧元素,D是所在周期原子半径最大的元素,故D为Na元素;六种元素所形成的常见单质在常温压下有三种是气体,三种是固体,故B、E的单质一种为气体、一种为固体,E的原子序数大于钠元素小于硫元素,故E为固体、B为气体,B的原子序数小于氧元素,则B为氮元素;由(3)可知,E是非金属元素,其单质在电子工业中有重要应用,则E为Si元素.
(1)F为S元素,处于周期表中:第三周期ⅥA族,D的离子为Na+,离子结构示意图为: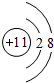 ,
,
故答案为:第三周期ⅥA族;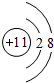 ;
;
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,则X为H2O2,Y为H2O,X的电子式为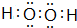 ,故答案为:
,故答案为: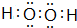 ;
;
(3)C与F形成的常见化合物为二氧化硫、三氧化硫,均属于分子晶体.若E的单质是常见的半导体材料则E为Si,则A与B形成的常见化合物R为NH3,C与D形成的常见化合物S为Na2O、C与E 形成的常见化合物T为SiO2,氨气形成分子晶体,氧化钠属于离子晶体,而二氧化硅属于原子晶体,故三者的沸点从高到低排列为:SiO2>Na2O>NH3,故答案为:分子;SiO2>Na2O>NH3;
(4)在10L的密闭容器中,通入2mol SO2气体和3mol O2气体,一定条件下反应后生成SO3气体,发生反应2SO2+O2?2SO3,当反应达到平衡时,O2的浓度为0.21mol/L,参加反应的氧气为3mol-0.21mol/L×10L=0.9mol,根据方程式可知,平衡时参加反应SO2的物质的量为0.9mol×2=1.8mol,故二氧化硫的转化率为$\frac{1.8mol}{2mol}$×100%=90%,故答案为:90%.
点评 本题考查结构性质位置关系、常用化学用语、晶体类型与性质、化学平衡有关计算等,题目较为综合,难度不大,旨在考查学生对基础知识的理解掌握,推断元素是解题关键.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 甲烷的燃烧 | B. | 由甲烷制取氯仿 | ||
| C. | 钠与水的反应 | D. | 硝酸银溶液与盐酸的反应 |
| A. | 胶粒直径在1~100nm之间 | B. | 胶粒作布朗运动 | ||
| C. | 胶粒通过吸附而带正电荷 | D. | 胶粒不能透过半透膜 |
| A. | 甲酸甲酯 | B. | 丙酸乙酯 | C. | 蔗糖 | D. | 麦芽糖 |
| A. |  稀释浓硫酸 | B. |  比较MnO2、CI2、I2的氧化性 | ||
| C. |  分离乙醇和水 | D. |  比较Na2CO3、NaHCO3的热稳定性 |
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: .
. ;
; .
.