题目内容
20.某烧瓶(已抽成真空)及瓶塞质量为100.00g,此烧瓶充满O2(标准状况下)后质量为101.60g(含瓶塞),则此烧瓶的容积为1.12L.若用此烧瓶用排空气法收集HCl气体,一段时间后,密封,称得烧瓶及瓶塞质量为101.75g.随机将其倒置于水槽中,如图所示,最终液面会上升至烧瓶总体积的$\frac{5}{6}$,烧瓶内溶液的物质的量浓度为$\frac{1}{22.4}$mol/L(不考虑溶质的扩散).
分析 计算氧气的质量,根据n=$\frac{m}{M}$计算氧气物质的量,再根据V=nVm计算氧气体积,烧瓶的容积等于氧气的体积;
用排空气法收集HCl,容器收集的气体物质的量等于氧气物质的量,计算平均相对分子质量,进而计算HCl、空气的体积之比,最终液面会上升体积HCl的体积,即溶液体积等于HCl体积,令溶液体积为1L,根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据c=$\frac{n}{V}$计算所得溶液浓度.
解答 解:容器内氧气的质量为101.60g-100.00g=1.60g,氧气物质的量为$\frac{1.60g}{32g/mol}$=0.05mol,则氧气体积为0.05mol×22.4L/mol=1.12L,即烧瓶的容积为1.12L;
用排空气法收集HCl,容器内气体物质的量为0.05mol,质量为101.75g-100.00g=1.75g,平均相对分子质量为$\frac{1.75}{0.05}$=35,设HCl、空气物质的量分别为xmol、ymol,则$\frac{36.5x+29y}{x+y}$=35,整理可得x:y=5:1,最终液面会上升体积HCl的体积,故最终液面会上升至烧瓶总体积的$\frac{5}{6}$,
所得溶液体积等于HCl体积,令溶液体积为1L,则HCl的物质的量$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,得溶液浓度为$\frac{\frac{1}{22.4}mol}{1L}$=$\frac{1}{22.4}$mol/L,
故答案为:1.12;$\frac{5}{6}$;$\frac{1}{22.4}$mol/L.
点评 本题考查物质的量有关计算,物质的量浓度计算关键是明确气体体积、溶液体积的关系,难度不大.

| A. | 1 mol甲烷的质量与甲烷的摩尔质量相等 | |
| B. | 28 g氮气与40 g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3 g钠和过量氧气反应,失去的电子数为0.1NA | |
| D. | 18 g重水(D2O)所含的电子数为10NA |
| A. | 苹果 | B. | 口杯 | C. | 篮球 | D. | 大象 |
| A. | 2mol CH4 | B. | 3mol NH3 | C. | 4mol H2O | D. | 6mol HCl |
| A. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| B. | 标准状况下,4.48L CO含有0.2NA个原子 | |
| C. | 22.4L Cl2中含有NA个Cl2分子 | |
| D. | 标准状况下,1.12L O2和1.12L CO2均含有0.1NA个氧原子 |
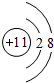 .
.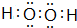 .
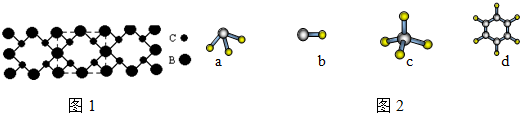
.

 在如图所示的三个相同的容器甲、乙、丙中进行如下反应:2NO+O2?2NO2
在如图所示的三个相同的容器甲、乙、丙中进行如下反应:2NO+O2?2NO2