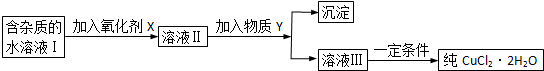
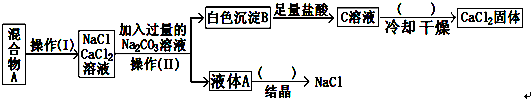
题目内容
下列电离方程式正确的是( )
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
考点:电离方程式的书写
专题:
分析:A.硫酸根为原子团,不能拆;
B.氯化铝为强电解质,电离生成铝离子和3个氯离子;
C.氢氧化钡为强电解质,完全电离;
D.钠离子书写错误.
B.氯化铝为强电解质,电离生成铝离子和3个氯离子;
C.氢氧化钡为强电解质,完全电离;
D.钠离子书写错误.
解答:
解:A.H2SO4为强电解质,完全电离,电离方程式为:H2SO4=2H++SO42-,故A错误;
B.氯化铝为强电解质,电离生成铝离子和3个氯离子,电离方程式为:AlCl3=Al3++3Cl-,故B错误;
C.氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故C正确;
D.碳酸钠为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选:C.
B.氯化铝为强电解质,电离生成铝离子和3个氯离子,电离方程式为:AlCl3=Al3++3Cl-,故B错误;
C.氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故C正确;
D.碳酸钠为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选:C.
点评:本题主要考查电离方程式书写,明确电解质的强弱、掌握正确书写电离方程式的方法是解答关键,题目难度不大.

练习册系列答案
相关题目
下列水解反应的化学方程式错误的是( )
| A、Fe3++3H2O═Fe(OH)3+3H+ |
| B、HSO3-+H2O?H2SO3+OH- |
| C、CH3COO-+H2O?CH3COOH+OH- |
| D、A13++3HCO3-═Al(OH)3↓+3CO2↑ |
下列说法正确的是( )
| A、小苏打是弱电解质,其水溶液导电能力很弱 |
| B、氨气是非电解质,但氨水能导电 |
| C、稀释醋酸溶液,可以促进醋酸分子电离使溶液pH减小 |
| D、硫酸是强电解质,在水溶液和熔融状态下均能导电 |
关于Cl-的说法正确的是( )
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有17个电子 |
| D、Cl-是稳定结构 |