题目内容
16.氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面.其制备工艺如图:
(1)制备过程的化学反应方程式为2Na+2C+2NH3$\frac{\underline{\;650℃\;}}{\;}$2NaCN+3H2.
(2)工厂中,氰化钠存储区应贴的标志图1为B(填选项字母).

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为
 .
.(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法.含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是BD(填选项字母).
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-)=c(OH-)-C(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=2.0×10-5(结果保留到小数点后一位).
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为NaCN+H2O2+H2O=MaHCO3+NH3↑.
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图2所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O.除去CN-的离子反应方程式为2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
分析 (1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气;
(2)氰化钠有毒,为剧毒品;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键;
(4)等物质的量的NaCN和HCN的混合溶液,其pH>7,说明CN-的水解程度大于氢氰酸的电离程度,导致溶液呈碱性,根据电荷守恒知,钠离子和氢氰根离子浓度的关系,据此分析;根据Kb=$\frac{Kw}{Ka}$计算;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,根据氧化还原反应配平;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子;ClO-可将CN-氧化为N2和CO32-,据此书写.
解答 解:(1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气,反应为:2Na+2C+2NH3$\frac{\underline{\;650℃\;}}{\;}$2NaCN+3H2;
故答案为:2Na+2C+2NH3$\frac{\underline{\;650℃\;}}{\;}$2NaCN+3H2;
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为: ;
;
故答案为: ;
;
(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O?HCN+OH-;Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{4.9×1{0}^{-10}}$≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
点评 本题以物质制备为载体,主要考查了化学方程式的书写、氧化还原反应、环境保护、溶液中离子浓度的比较、电解池的原理、弱电解质的电离平衡、水解平衡等,注意电离平衡常数的应用,结合电荷守恒来分析解答,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
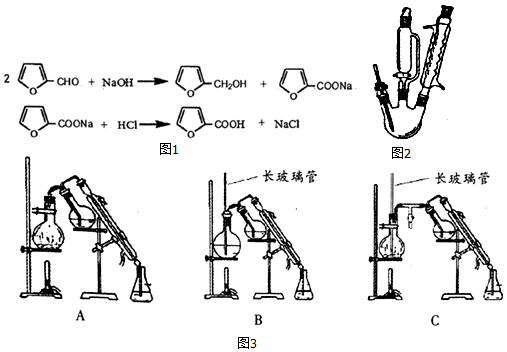
几种有机物性质如表:
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
呋喃甲酸的实验室制备方法如图2:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟.向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.5g.
回答以下问题:
(1)三颈瓶中反应需要搅拌回流30分钟的原因是呋喃甲醛微溶于水,搅拌充分混合加快反应速率.
(2)呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法冷水浴.
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是C.
A、直接用50mL乙醚萃取分液
B、将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化.配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是用量筒分别量取66ml水、34ml浓盐酸,于烧杯中混合,用玻璃棒搅拌均匀;判断盐酸加入足量的方法是使用刚果红试纸测定溶液pH,当试纸变蓝紫色时,说明加入盐酸足量 (上层清液中继续滴加盐酸,不产生浑浊,说明盐酸加入足量).
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:在水浴上进行蒸馏,切忌直接明火加热;水蒸气蒸馏的方法应选择(图3)C(填字母序号);
(6)计算呋喃甲酸的产率67%.

| A. | 图中N型半导体为负极,P型半导体为正极 | |
| B. | 图中离子交换膜为阴离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O=CO+2OH- |
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
| A. | mg该磁黄铁矿中含+2价的铁0.75mol | |
| B. | 200mL盐酸中HCl物质的量浓度为4.25mol•L-1 | |
| C. | 生成的H2S气体在标准状况下的体积为16.8L | |
| D. | 该磁黄铁矿中Fe1-nS的n=0.15 |
| A. |  将海带灼烧灰化 | B. | 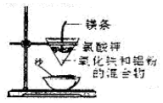 铝热反应 | ||
| C. | 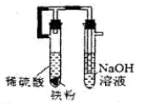 制取氢氧化亚铁 | D. |  验证铁的吸氧腐蚀 |