题目内容
0.1mol/L的NH4Cl溶液中,下列离子浓度大小比较正确的是( )
| A、C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| B、C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| C、C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| D、C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:NH4Cl为强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以C(H+)>C(OH-),铵根离子水解程度较小,再结合电荷守恒解答.
解答:
解:NH4Cl为强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以C(H+)>C(OH-),铵根离子水解程度较小,所以C(Cl-)>C(NH4+),铵根离子水解程度较小,所以C(NH4+)>C(H+),则溶液中离子浓度大小顺序是C(Cl-)>C(NH4+)>C(H+)>C(OH-),
故选D.
故选D.
点评:本题考查了离子浓度大小比较,根据盐的特点结合“谁强谁显性、谁弱谁水解”确定溶液酸碱性,再结合电荷守恒判断,注意盐类水解程度较小,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应不属于氧化还原反应的是( )
| A、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| B、Cu+2FeCl3═CuCl2+2FeCl2 |
| C、HCl+NaHCO3=NaCl+H2O+CO2↑ |
| D、3Cl2+6NaOH=5NaCl+NaClO3+3H2O |
等物质的量浓度的NaCl、MgCl2两种溶液的体积比为3:2,则两种溶液中Cl-的物质的量浓度之比为( )
| A、1:2 | B、3:4 |
| C、1:1 | D、3:2 |
19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了( )
| A、大量铝土矿 |
| B、电解氧化铝制取铝的方法 |
| C、用金属钠还原氧化铝的方法 |
| D、无水氯化铝与钾制取铝的方法 |
等质量的铝粉,分别与等体积的氢氧化钠溶液和硫酸恰好完全反应,则氢氧化钠溶液和硫酸的物质的量浓度之比是( )
| A、2:3 | B、3:2 |
| C、1:1 | D、1:2 |
下列说法正确的是( )
| A、常温常压下,11.2L氯气所含的原子数为NA |
| B、常温常压下,1mol氦气含有的核外电子数为4NA |
| C、17g氨气所含的电子数目为10NA |
| D、同温同压下,相同体积的任何气体单质所含的原子数目相同 |
下列物质互为同分异构体的是( )
A、
| ||||
| B、氧气和臭氧 | ||||
| C、甲烷和乙烷 | ||||
| D、正丁烷和异丁烷 |
不能用Cl2跟金属直接化合制取的是( )
| A、AlCl3 |
| B、FeCl2 |
| C、CuCl2 |
| D、NaCl. |
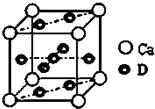 A,B,C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A,B,C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空: