题目内容
2.根据某些性质,可将CaO、CuO归为一类氧化物.下列物质中也属于这类氧化物的是( )| A. | SO2 | B. | Na2O | C. | CO | D. | Na2O2 |
分析 氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.氧化物可根据构成元素分为:金属氧化物、非金属氧化物;根据能否和酸、碱反应生成盐和水,氧化物又可分为:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物.能和酸反应生成盐和水,属于碱性氧化物,CaO、CuO是金属氧化物,也是碱性氧化物.
解答 解:CaO、CuO是金属氧化物,也是碱性氧化物.
A、SO2是非金属氧化物,还是酸性氧化物,故A不符合;
B、Na2O是金属氧化物,也是碱性氧化物,故B符合;
C、CO是非金属氧化物,还是不成盐氧化物,故C不符合;
D、Na2O2与酸反应生成盐和水以及氧气,不属于碱性氧化物,故D不符合;
故选B.
点评 本题考查了氧化物的分类问题,注意氧化物根据不同的分类标准有两种分类方法,题目难度不大.

练习册系列答案
相关题目
12.常温下测得某无色溶液中由水电离出c (H+)为10-13mol/L,该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
13.关于阿伏伽德罗常数NA,下列叙述正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
10.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
17.下列离子方程式中正确的是( )
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
14.下列物质在自然界中能稳定存在的是( )
| A. | 过氧化钠 | B. | 氧化钠 | C. | 碳酸钠 | D. | 氢氧化钠 |
6.1000ml某无色待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH-(浓)=NH3↑+H2O)
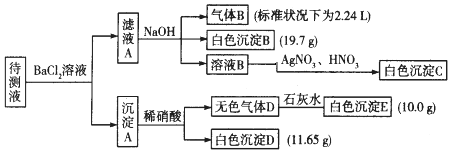
(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |

(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.