题目内容
12.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )| A. | CH4与CH2Cl2均为正四面体 | B. | BeCl2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | NO3-与CO32-为平面三角形 |
分析 根据价层电子对互斥理论确定微粒的空间构型,价层电子对个数=σ键个数+孤电子对个数,以此解答该题.
解答 解:A.CH2Cl2含有C-H、C-Cl键,键长不等,则不是正四面体,故A错误;
B.SO2分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有1个孤电子对,所以为V形结构,故B错误;
C.BF3分子中B原子的价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含有孤电子对,所以其空间构型为平面三角形,故C错误;
D.NO3-中,价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5+1-3×2)=3,含孤电子对数为0,杂化轨道数3,N原子采用sp2杂化,分子形状为平面三角形;CO32-中碳原子价层电子对个数=3+$\frac{4-3×2+2}{2}$=3,采用sp2杂化,所以CO32-的离子立体结构为为平面三角形,故D正确;
故选D.
点评 本题考查了原子杂化方式的判断和微粒的空间构型的判断,为高频考点,侧重考查学生的分析能力,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
2.科学家最近发现一种不需外能源,可以除去废水中卤代烃(卤代烃危害人类健康)的方法,即把铁粉放在废水中,一段时间后,卤代烃“消失”,有人提出该过程的机理为:Fe+RCH2X+H+-→RCH3+X-+Fe2+(X为卤素).下列说法中正确的是( )
| A. | 若卤代烃的分子式为C4H9X,则RCH2X有5种结构 | |
| B. | 该反应是置换反应 | |
| C. | 反应过程中RCH2X是氧化剂 | |
| D. | 处理含1 mol卤代烃的废水时,转移4 mol电子 |
20.青蒿酸是合成青蒿素的原料,可以由香草醛合成: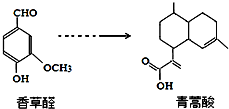 下列有关叙述正确的是( )
下列有关叙述正确的是( )
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 香草醛的分子式是C8H10O3 | |
| B. | 香草醛能与NaHCO3溶液反应 | |
| C. | 两种物质均可与溴的四氯化碳溶液发生加成反应 | |
| D. | 可用FeCl3溶液检验青蒿酸中是否含香草醛 |
7.下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是( )
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
17.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1mol N2在一定条件下反应所得混合气体分子数小于2NA |
1.关于化学式为[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,形成配位键时提供电子对 | |
| C. | 配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1:2 | |
| D. | 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol |
2.如图所示,a和b是盐酸和氢氧化钠溶液相互反应的pH值变化曲线,下列说法不正确的是( )

| A. | NaOH的物质的量浓度:c(NaOH)=0.1mol•L-1 | |
| B. | a和b曲线上的任何一点都有:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | P点溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | 曲线b是氢氧化钠溶液中逐滴加入盐酸的pH值变化曲线 |
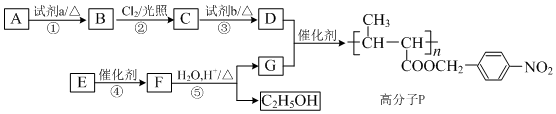
 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$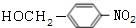 +NaCl.
+NaCl.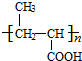 .
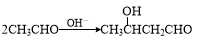
.
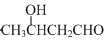 .
. 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.