题目内容
12.下列实验符合“绿色环保”思想的是( )| A. |  制氯水 | B. |  铜与浓硫酸反应 | ||
| C. |  制氯化氢气体 | D. |  一氧化碳还原氧化铜 |
分析 A.氯气在水中的溶解度不大;
B.Cu与浓硫酸加热反应生成二氧化硫,二氧化硫可使品红褪色,且棉花可防止气体逸出;
C.排空气法收集HCl,可能HCl气体逸出;
D.CO还原CuO应处理CO尾气.
解答 解:A.氯气在水中的溶解度不大,可能导致氯气污染环境,故A错误;
B.Cu与浓硫酸加热反应生成二氧化硫,二氧化硫可使品红褪色,且浸有碱液的棉花可吸收尾气,装置合理,故B正确;
C.排空气法收集HCl,可能HCl气体逸出,不符合绿色化学,故C错误;
D.CO还原CuO应处理CO尾气,则装置不合理,应在两边开口的大试管中加热,最后点燃法处理尾气,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验装置的作用、气体的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验操作及实验评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)BCl3的空间构型为;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2═CsCl+ICl
B. CsICl2═CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D.
A. HCl B.HF C.CO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3杂化,写出CN-的等电子体的分子式(写出1个)N2或CO.
(6)由H、N、O三种元素组成的常用作化肥,且水溶液显酸性化合物固态时属于离子晶体,假设其晶体的空间结构与氯化钠相似,且晶胞的棱长为acm,则该晶胞的密度为$\frac{320}{{N}_{A}•{a}^{3}}$g/cm3.
(1)BCl3的空间构型为;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2═CsCl+ICl
B. CsICl2═CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(KJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C.CO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3杂化,写出CN-的等电子体的分子式(写出1个)N2或CO.
(6)由H、N、O三种元素组成的常用作化肥,且水溶液显酸性化合物固态时属于离子晶体,假设其晶体的空间结构与氯化钠相似,且晶胞的棱长为acm,则该晶胞的密度为$\frac{320}{{N}_{A}•{a}^{3}}$g/cm3.
3.关于钠与水反应的现象,下列说法错误的是( )
| A. | 钠熔化成银白色小球 | B. | 钠沉在水底 | ||
| C. | 反应剧烈 |
20.铝在空气中能够稳定存在的原因是( )
| A. | 铝的性质不活泼 | B. | 铝的还原性弱 | C. | 铝与氧气不反应 | D. | 铝表面有氧化膜 |
17.下列正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| C. | 用浓NaOH溶液溶解Al2O3:OH-+Al2O3═AlO2-+H2O | |
| D. | 可以用互滴法鉴别稀HCl溶液与NaAlO2溶液 |
4.关于如图所示的装置叙述正确的是( )


| A. | 装置A是电解池,装置B是原电池 | |
| B. | 装置A是原电池,装置B是电解池 | |
| C. | 电子由装置A中碳棒流向装置B中碳棒 | |
| D. | 工作一段时间后,A装置中稀H2SO4溶液质量减轻,B装置中CuCl2质量减轻 |
1.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 钠和水反应:2Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
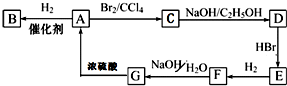 图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
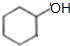 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O反应类型是消去反应.由F生成G的化学方程式
+H2O反应类型是消去反应.由F生成G的化学方程式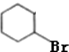 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +2H2O.
+2H2O.